Содержание
- 2. Элементы VIА-подгруппы являются неметаллами, кроме Po. Связь между атомами в простых веществах – ковалентная. Кислород сильно
- 3. Основные вопросы, рассматриваемые в лекции Неметаллы VIА-подгруппы Общая характеристика неметаллов VIА-подгруппы. Природные соединения Сера Простое вещество
- 4. Общая характеристика Атомам не хватает двух электронов для формирования устойчивой восьмиэлектронной оболочки. Минимальная степень окисления (–2)
- 5. Элементы VIА-подгруппы часто объединяют под общим названием «халькогены», что означает «образующие руды». Действительно многие металлы находятся
- 6. Сера Характерные степени окисления Среди всех неметаллов VIА-подгруппы наибольшее значение после кислорода имеет сера. Сера образует
- 7. Содержание S в земной коре составляет около 0,04 масс.%. Она встречается в виде простого вещества, образующего
- 8. Простое вещество В простом веществе атомы серы связаны σ-связью с двумя соседними за счет неспаренных электронов.
- 9. Простое вещество Сера может быть окислена (обычно до SO2), и может быть восстановлена до S(-2). При
- 10. Простое вещество В реакциях с водородом и металлами сера выступает в роли окислителя. При пропускании Н2
- 11. Соединения серы Сероводород H2S – это бесцветный газ с запахом тухлых яиц, ядовит. Мало растворяется в
- 12. Соединения серы Сульфиды. Это соли сероводородной кислоты. Известно много природных сульфидов. Сульфиды многих тяжелых цветных металлов
- 13. Соединения серы Сульфиды и H2S проявляют восстановительные свойства H2S, S2– + окислитель ⭢ S, (SO2, SO42–)
- 14. Диоксид серы SO2 – это бесцветный тяжелый газ с резким удушливым запахом; ядовит. Жидкий SO2 используется
- 15. SO2 и сульфиты проявляют восстановительные свойства и окисляются в водных растворах до сульфатов. SO2 (г.), SO32–
- 16. Триокид серы SO3 при обычных условиях – твердое белое вещество. У SO3 сильно выраженные кислотные свойства.
- 17. Серная кислота – сильная двухосновная кислота. В воде она диссоциирует по схеме: H2SO4 ⮀ H+ +
- 18. В концентрированной серной кислоте окислителем выступает сульфат-ион. SO42– + восстановитель ⭢ SO2, S, H2S Продукт восстановления
- 19. Самым широко используемым соединением серы в промышленности является серная кислота. Мировой объем производства H2SO4составляет 136 млн.т/год.
- 20. Большинство сульфатов растворимо в воде, за исключением сульфатов свинца, стронция, бария и малорастворимого CaSO4. Реакцию Ba2+
- 21. Политионовые кислоты. Это двухосновные кислоты. Общую формулу политионовых кислот можно записать как H2SxO6 или в следующем
- 22. Пероксосерные кислоты – это кислоты, содержащие группу –О–О–. Пероксомоносерная кислота H2SO5 , в ней одна из
- 23. Фторсульфоновая кислота HSO3F – очень сильная кислота. Формально ее можно рассматривать как результат замещения в серной
- 24. Простые вещества Se и Te являются весьма ценными материалами. Серый кристаллический селен используется в фотоэлементах и
- 25. Селен имеет несколько полиморфных форм. Более устойчивым является серый селен – кристаллическое вещество. Менее устойчивыми формами
- 26. Селен и теллур окисляются кислородом с образованием диоксидов ЭО2 только при нагревании. На воздухе оба неметалла
- 27. Щелочные металлы, медь и серебро образуют селениды и теллуриды, которые можно рассматривать как соли селено- и
- 28. Диоксиды селена и теллура – кристаллические вещества. Оксид SeO2 – хорошо растворяется в воде, образуя селенистую
- 29. Селениты и теллуриты похожи на сульфиты. При действии на них сильных кислот получаются селенистая и теллуристая
- 30. Триоксид SeO3 – твердое белое вещество, образованное молекулами тримера (SeO3)3. Триоксид селена хорошо растворяется в воде,
- 31. Селеновая кислота H2SeO4 в чистом виде – это бесцветное твердое вещество, хорошо растворимое в воде. Селеновая
- 33. Скачать презентацию






























 Процессы проявления и фиксирования
Процессы проявления и фиксирования Кристаллы. Выращивание кристалла
Кристаллы. Выращивание кристалла Каучук. Немного из истории
Каучук. Немного из истории Резина. Состав и применение резины
Резина. Состав и применение резины Металдар коррозиясы және онымен күресу шаралары
Металдар коррозиясы және онымен күресу шаралары Дисперсные системы. 11 класс
Дисперсные системы. 11 класс Каучук. Открытие каучука
Каучук. Открытие каучука Строение атома и периодическая система Д.И. Менделеева
Строение атома и периодическая система Д.И. Менделеева Валентность химических элементов. 8 класс
Валентность химических элементов. 8 класс Пниктогены элеметны VA группы
Пниктогены элеметны VA группы Аммиак (9 класс)
Аммиак (9 класс) Жидкие кристаллы
Жидкие кристаллы Углеводы Cn(H2O)m
Углеводы Cn(H2O)m Аммиак. Строение молекулы аммиака, его физические и химические свойства
Аммиак. Строение молекулы аммиака, его физические и химические свойства Алкадиены (диеновые углеводороды)
Алкадиены (диеновые углеводороды) Получение ткани
Получение ткани Solutions and solubilities
Solutions and solubilities Фосфор и его соединения
Фосфор и его соединения Применение алканов
Применение алканов Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Основные понятия и законы химии
Основные понятия и законы химии Щелочноземельные металлы. Металлы II А подгруппы
Щелочноземельные металлы. Металлы II А подгруппы Химия в кастрюле
Химия в кастрюле Природные и синтетические полимеры
Природные и синтетические полимеры Группа веществ, изолируемых из биологического материала дистилляцией
Группа веществ, изолируемых из биологического материала дистилляцией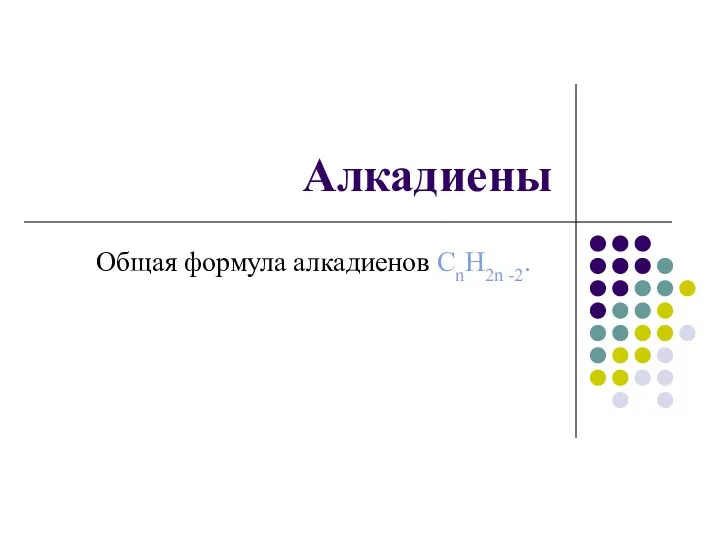 Алкадиены. Общая формула алкадиенов CnH2n -2
Алкадиены. Общая формула алкадиенов CnH2n -2 Дисперсная система
Дисперсная система Цинк. Месторождения. Применение
Цинк. Месторождения. Применение