Слайд 2

История названия.
Аммиак (в европейских языках его название звучит как «аммониак») своим
названием обязан оазису Аммона в Северной Африке.
Аммиак получил своё название от древнеегипетского слова амониан. Так называли людей, поклоняющихся богу Амону. Так называли людей, поклоняющихся богу Амону. Они во время своих ритуальных обрядов нюхали нашатырь NH4Cl, который при нагревании испаряет аммиак.
Слайд 3

Аммиак.
Аммиа́к — NH3, нитрид — NH3, нитрид водорода, при нормальных условиях — NH3, нитрид водорода, при нормальных условиях — бесцветный газ с
резким характерным запахом (запах нашатырного спирта — NH3, нитрид водорода, при нормальных условиях — бесцветный газ с резким характерным запахом (запах нашатырного спирта), почти вдвое легче воздуха, ПДК 20 мг/м3 — IV класс опасности (малоопасные вещества).
Слайд 4

Строение Аммиака.
Молекула аммиака имеет форму тригональной пирамиды с атомом азота в
вершине.
Слайд 5

Получение.
Промышленный способ получения аммиака основан на прямом взаимодействии водорода и азота:
N2(г) +
3H2(г) ↔ 2NH3(г) + 91,84 кДж
Это так называемый процесс Габера (немецкий физик, разработал физико-химические основы метода).
Слайд 6
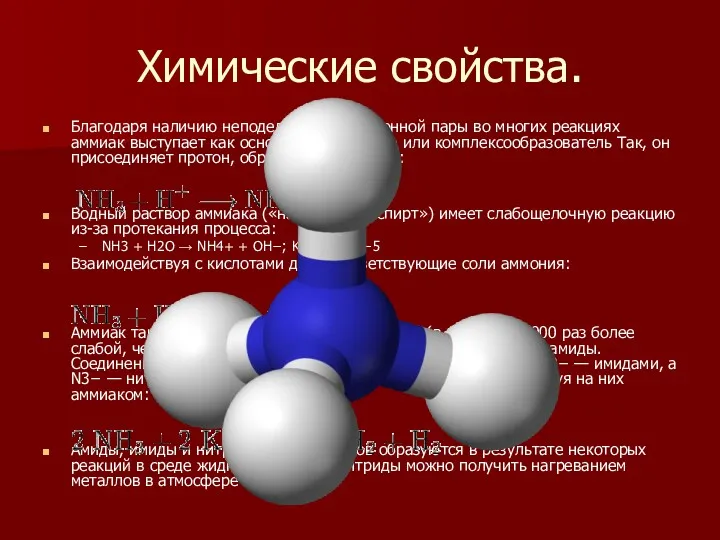
Химические свойства.
Благодаря наличию неподеленной электронной пары во многих реакциях аммиак
выступает как основание Бренстеда или комплексообразователь Так, он присоединяет протон, образуя ион аммония:
Водный раствор аммиака («нашатырный спирт») имеет слабощелочную реакцию из-за протекания процесса:
NH3 + H2O → NH4+ + OH−; Ko=1,8×10−5
Взаимодействуя с кислотами даёт соответствующие соли аммония:
Аммиак также является очень слабой кислотой (в 10 000 000 000 раз более слабой, чем вода), способен образовывать с металлами соли — амиды. Соединения, содержащие ионы NH2−, называются амидами, NH2− — имидами, а N3− — нитридами. Амиды щелочных металлов получают, действуя на них аммиаком:
Амиды, имиды и нитриды ряда металлов образуются в результате некоторых реакций в среде жидкого аммиака. Нитриды можно получить нагреванием металлов в атмосфере азота.
Слайд 7
Биологическая роль.
Аммиак является конечным продуктом азотистого обмена в организме человека и животных.
Аммиак
может также использоваться печенью для обратного процесса — ресинтеза аминокислот из аммиака и кетоаналогов аминокислот.
Слайд 8
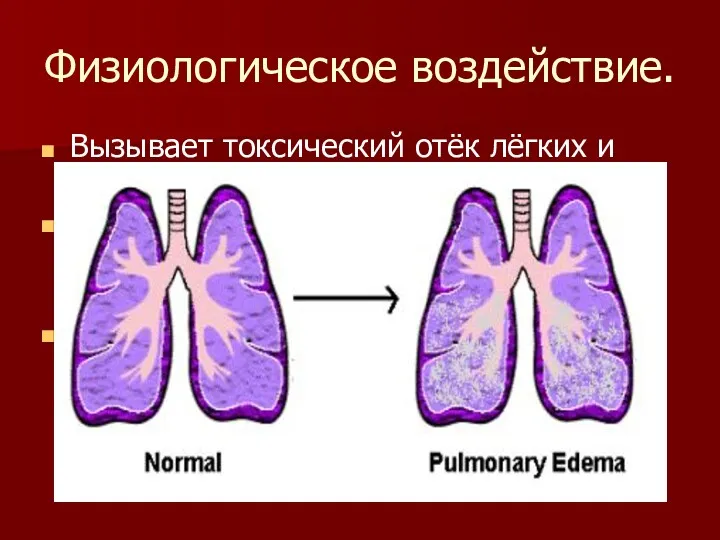
Физиологическое воздействие.
Вызывает токсический отёк лёгких и тяжёлое поражение нервной системы.
Раздражает слизистые
оболочки глаз и органов дыхания, а также кожные покровы.
Кроме того, сжиженный аммиак при испарении поглощает тепло, и при соприкосновении с кожей возникает обморожение различной степени.
Слайд 9

Применение.
Производства азотных удобрений.
Производства взрывчатых веществ и полимеров.
Производства азотной кислоты и соды.
В холодильной
технике используется в качестве холодильного агента (R717).
В медицине (10 % раствор аммиака).
В строительстве (как ускоритель процесса затвердевания).
Слайд 10

Интересные факты:
Пары нашатырного спирта способны изменять окраску цветов. Например, голубые и синие лепестки
становятся зелеными, ярко красные — черными.
Облака Юпитера состоят из аммиака.
Некоторые цветы, не имеющие запаха от природы, после обработки аммиаком начинают благоухать. Например, приятный аромат приобретают астрыНекоторые цветы, не имеющие запаха от природы, после обработки аммиаком начинают благоухать. Например, приятный аромат приобретают астры[12]









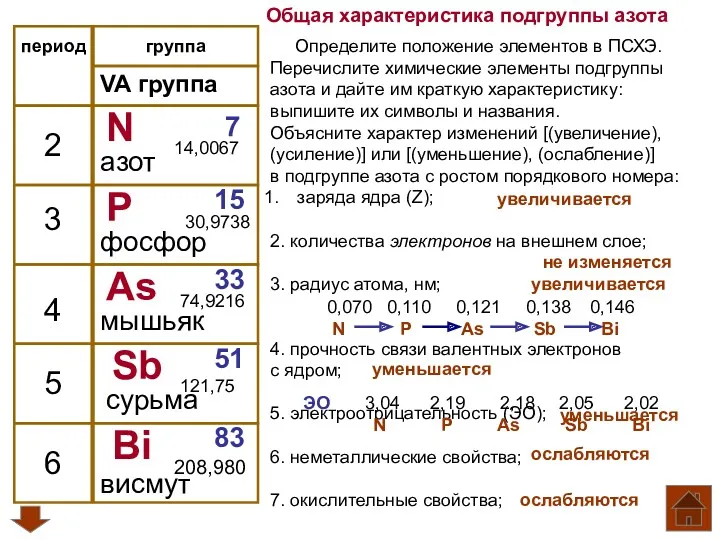 Общая характеристика подгруппы азота
Общая характеристика подгруппы азота Энергетика химических процессов
Энергетика химических процессов Арени. Бензен: молекулярна і структурна формули, фізичні властивості
Арени. Бензен: молекулярна і структурна формули, фізичні властивості Тайна великого открытия периодической таблицы
Тайна великого открытия периодической таблицы Электролитическая диссоциация. 9 класс
Электролитическая диссоциация. 9 класс Современные конструкционные материалы
Современные конструкционные материалы Соединения азота. Оксиды азота
Соединения азота. Оксиды азота Титриметрический анализ. (Лекция 22)
Титриметрический анализ. (Лекция 22) Значення періодичного закону
Значення періодичного закону Полимеры. Протезы трахеи
Полимеры. Протезы трахеи №9 зертханалық жұмыс
№9 зертханалық жұмыс Алкадиены
Алкадиены Элемент свинец Рb
Элемент свинец Рb Циклические алифатические углеводороды
Циклические алифатические углеводороды Химический состав клетки. Неорганические соединения
Химический состав клетки. Неорганические соединения Теория твердения минеральных вяжущих веществ
Теория твердения минеральных вяжущих веществ Галогены. Химические свойства. Применение
Галогены. Химические свойства. Применение Классы неорганических веществ (лекция № 4)
Классы неорганических веществ (лекция № 4) Важнейшие реакции в органической химии
Важнейшие реакции в органической химии Композиционные материалы
Композиционные материалы Матеріали на основі аерогелів: класифікація, підходи до синтезу та сфери застосування
Матеріали на основі аерогелів: класифікація, підходи до синтезу та сфери застосування Химическая стойкость тугоплавких металлов в различных реагентах
Химическая стойкость тугоплавких металлов в различных реагентах The Sulphur cycle. The Sulphur dioxide problems
The Sulphur cycle. The Sulphur dioxide problems Кислородсодержащие органические соединения. 9 класс
Кислородсодержащие органические соединения. 9 класс Классификация и номенклатура неорганических соединений (Малый химический тренажёр)
Классификация и номенклатура неорганических соединений (Малый химический тренажёр) Строение атома. Классификация ядер атомов
Строение атома. Классификация ядер атомов Химический состав прямогонных бензинов
Химический состав прямогонных бензинов Химико-токсикологическое исследование отравлений отдельными лекарственными препаратами
Химико-токсикологическое исследование отравлений отдельными лекарственными препаратами