Содержание
- 2. Производные барбитуровой кислоты Используются в качестве седативно-снотворных, противоэпилептических и средств для наркоза, для усиления действия нейролептиков,
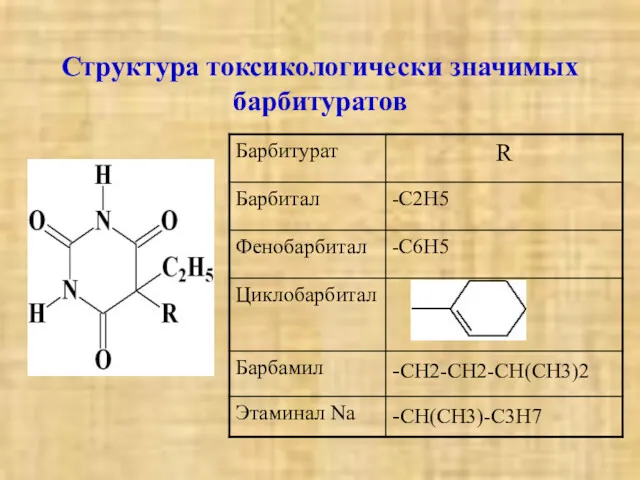
- 3. Структура токсикологически значимых барбитуратов
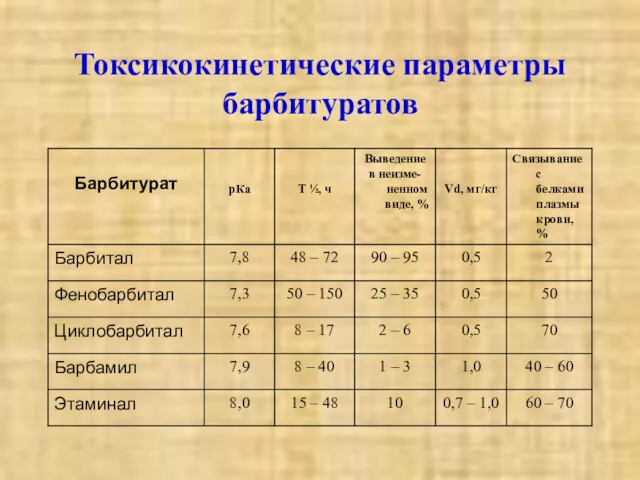
- 4. Токсикокинетические параметры барбитуратов
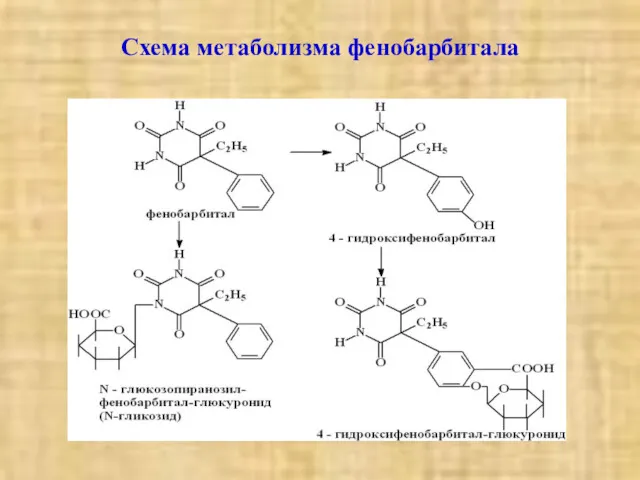
- 5. Схема метаболизма фенобарбитала
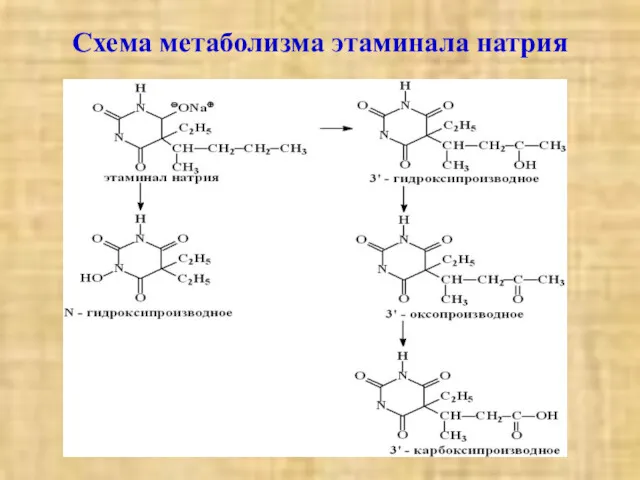
- 6. Схема метаболизма этаминала натрия
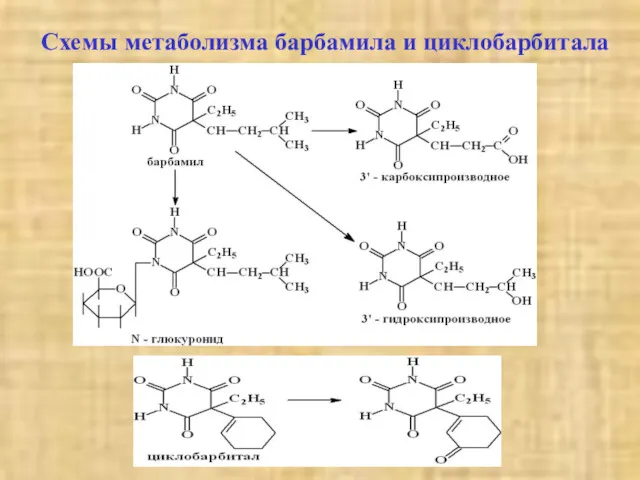
- 7. Схемы метаболизма барбамила и циклобарбитала
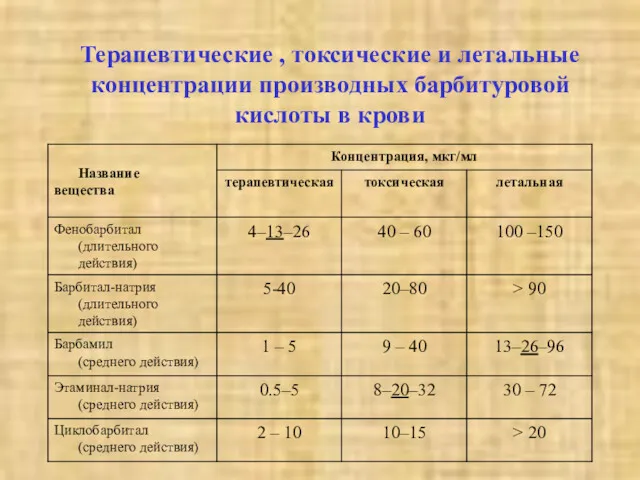
- 8. Терапевтические , токсические и летальные концентрации производных барбитуровой кислоты в крови
- 9. Токсикокинетические свойства барбитуратов
- 10. Выделение из биологических объектов Трупный материал: печень, почки, мозг, желудок с содержимым, кишечник – Изолирование подщелоченной
- 11. Химико-токсикологическое исследование на барбитураты Предварительные: Иммунные методы (ИХА, ИФА, ПФИА) Мурексидная проба С солями кобальта в
- 12. ТСХ барбитуратов Общая система : Ацетон – хлороформ ( 1 : 9 ) Частные системы :
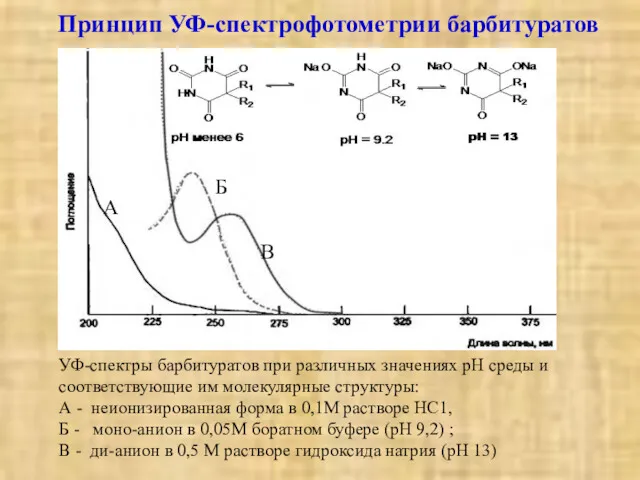
- 13. Принцип УФ-спектрофотометрии барбитуратов УФ-спектры барбитуратов при различных значениях рН среды и соответствующие им молекулярные структуры: А
- 14. Количественное определение барбитуратов методом УФ-спектрометрии К 1 мл крови (плазмы, сыворотки) или 0,5 мл мочи добавляют
- 15. ГХ исследование барбитуратов Капиллярные колонки с неполярными фазами типа НР-1, НР-5 Изотерма 180°С, 200°С для барбитала,
- 16. ВЭЖХ барбитуратов Обращенно-фазные колонки типа С8 или С18 Подвижная фаза: смесь ацетонитрил-дистиллированная вода (35:65) или 0,05
- 17. Методы ГЖХ и ВЭЖХ с различными детектирующими системами используются как для идентификации конкретных барбитуратов, так и
- 18. Производные 1,4- бензодиазепина *Вместо С = О в положении 2 стоит группа СН2; ** Вместо С
- 19. Механизм терапевтического действия взаимодействие со специфическими бензодиазепиновыми рецепторами постсинаптических ГАМК-рецепторных комплексах. Повышают чувствительность этих рецепторов к
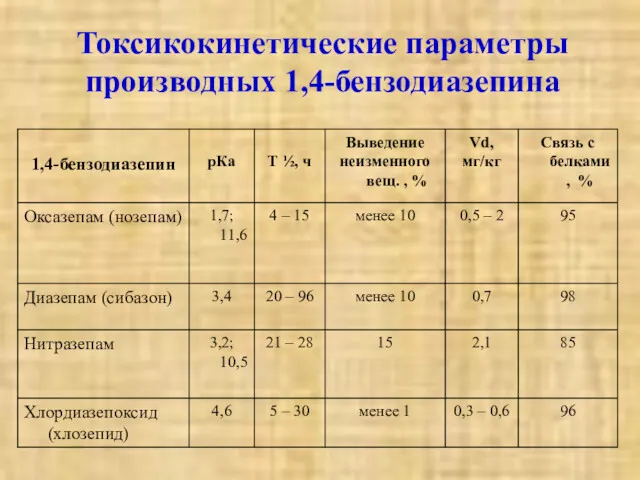
- 20. Токсикокинетические параметры производных 1,4-бензодиазепина
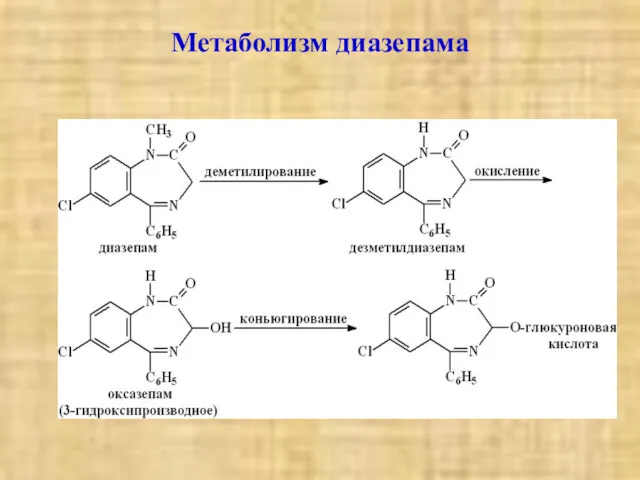
- 21. Метаболизм диазепама
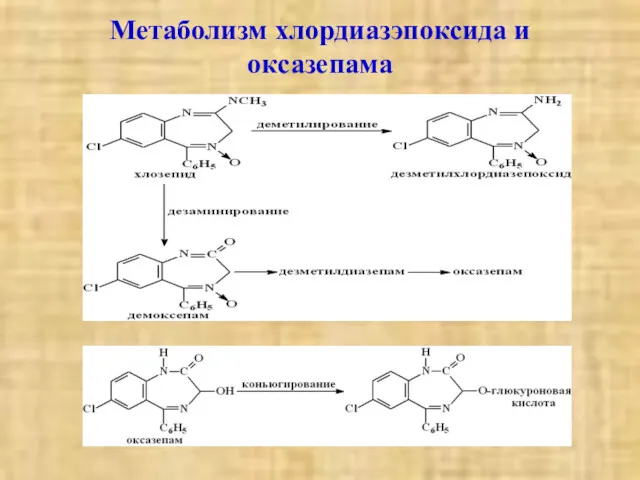
- 22. Метаболизм хлордиазэпоксида и оксазепама
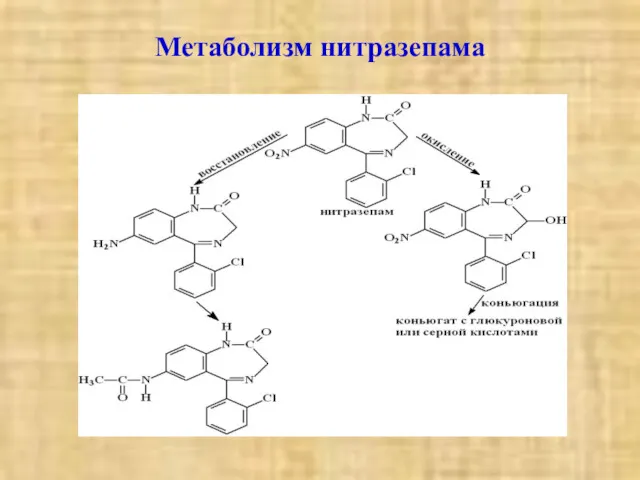
- 23. Метаболизм нитразепама
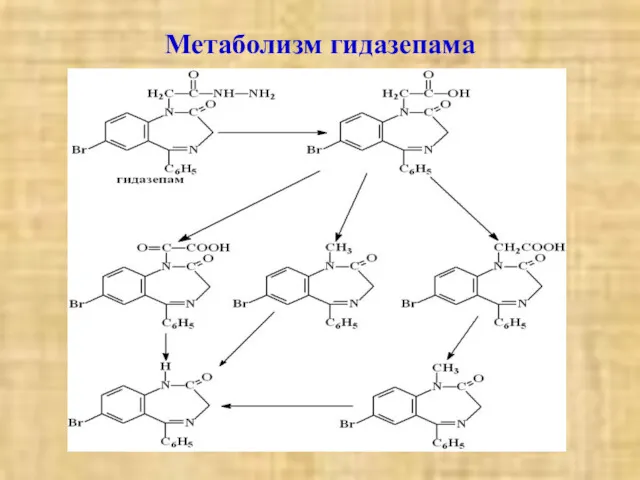
- 24. Метаболизм гидазепама
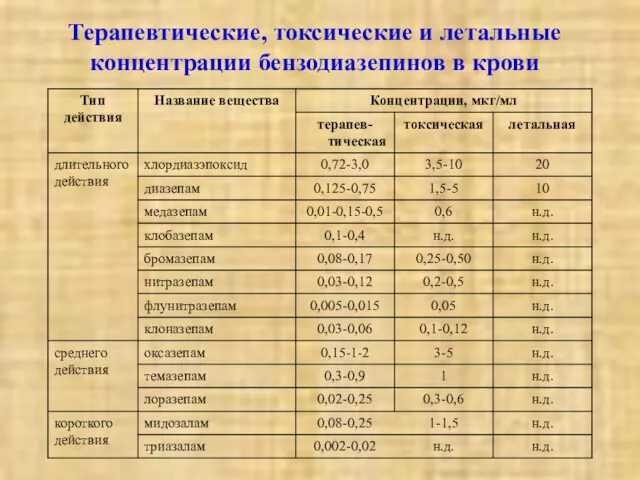
- 25. Терапевтические, токсические и летальные концентрации бензодиазепинов в крови
- 26. Методы изолирования производных 1,4-бензодиазепина Проявляют свойства как кислоты, так и основания, поэтому для выделения нативных бензодиазепинов
- 27. Диагностика отравлений производными 1,4 -бензодиазепина Анализ по двум направлениям : бензофенонам и по нативным веществам Первое
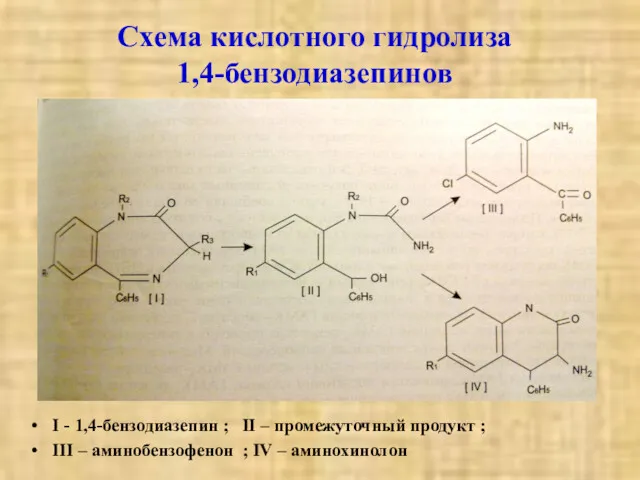
- 28. Схема кислотного гидролиза 1,4-бензодиазепинов I - 1,4-бензодиазепин ; II – промежуточный продукт ; III – аминобензофенон
- 29. ТСХ анализ бензодиазепинов Системы : Гексан – метанол – ацетон (15:3:1); Бензол – ацетон – этанол
- 30. Обнаружение нативных соединений и метаболитов производных 1,4 бензодиазепина Реактив Драгендорфа образует оранжевые или желто-оранжевые пятна, бурые;
- 31. ГЖХ определение производных 1,4-бензодиазепина Набивные колонки с неполярными или слабополярными фазами типа SE-30 или OV-17 или
- 32. ВЭЖХ определение производных 1,4-бензодиазепина ВЭЖХ-анализ производных бензодиазепина по нативным веществам или продуктам гидролиза. Колонка с обращенно-фазным
- 33. Количественное определение производных бензодиазепина по продуктам гидролиза методом спектрофотометрии Принцип метода - колориметрия после кислотного гидролиза
- 34. Методы ГЖХ и ВЭЖХ с различными детектирующими системами используются как для идентификации конкретных производных бензодиазепина, так
- 35. Нейролептики. Производные фенотиазина
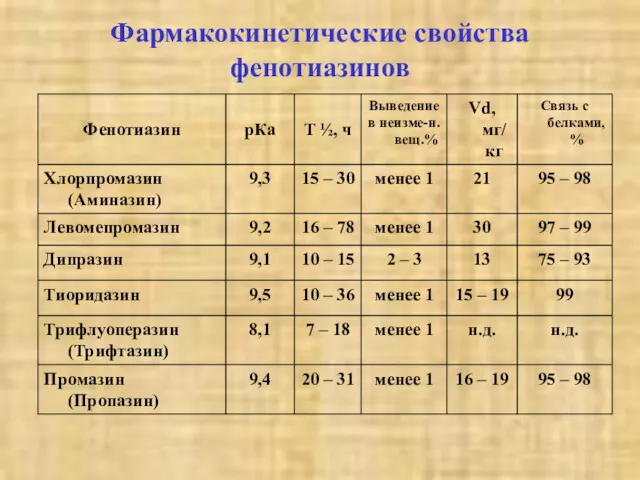
- 36. Фармакокинетические свойства фенотиазинов
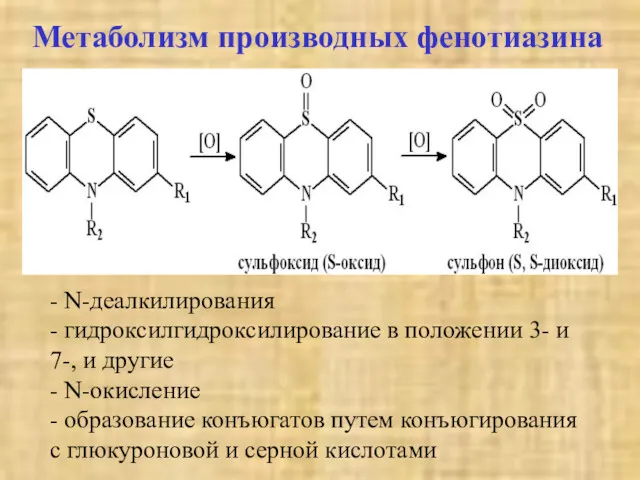
- 37. Метаболизм производных фенотиазина - N-деалкилирования - гидроксилгидроксилирование в положении 3- и 7-, и другие - N-окисление
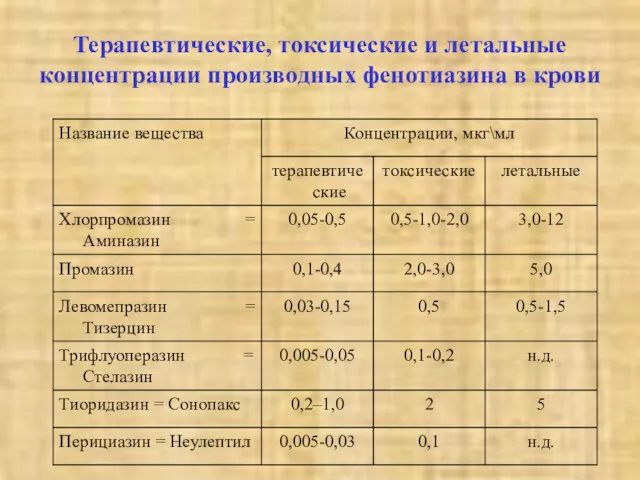
- 38. Терапевтические, токсические и летальные концентрации производных фенотиазина в крови
- 39. Изолирование фенотиазинов из трупного материала Метод В.Ф. Крамаренко Метод Е.М. Соломатина: 100 г измельченного биоматериала настаивают
- 40. Диагностика острых отравлений Предварительная проба в моче : FNP – реактив (смесь водных растворов хлорида железа
- 41. Обнаружение фенотиазинов Предварительные пробы с FNP-реактивом Конц. H2SO4 – пурпурно-красная Конц. HNO3 – пурпурно-фиолетовая Конц. HCl
- 42. ТСХ определение фенотиазинов Системы: бензол – диоксан – 25% раствор аммиака (60:35:5) этилацетат – ацетон –
- 43. Количественное определение производных фенотиазина Спектрофотометрия продукта реакции производного фенотиазина с метилоранжем. Без предварительной очистки при отсутствии
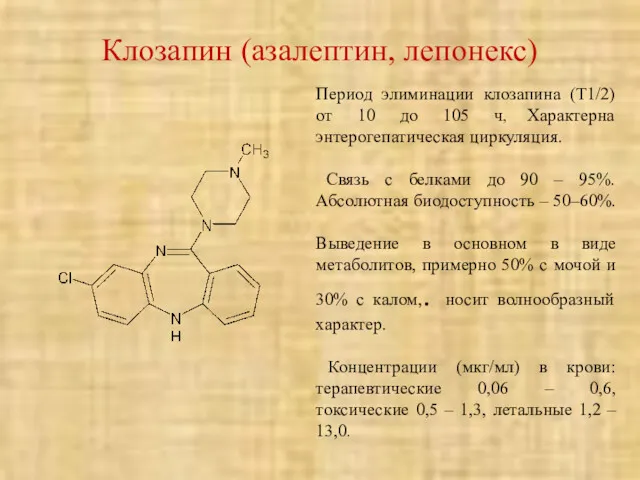
- 44. Клозапин (азалептин, лепонекс) Период элиминации клозапина (Т1/2) от 10 до 105 ч, Характерна энтерогепатическая циркуляция. Связь
- 45. Метаболизм клозапина
- 46. Идентификация клозапина Экстракция при рН = 8 – 9 хлороформом ТСХ в общих системах для веществ
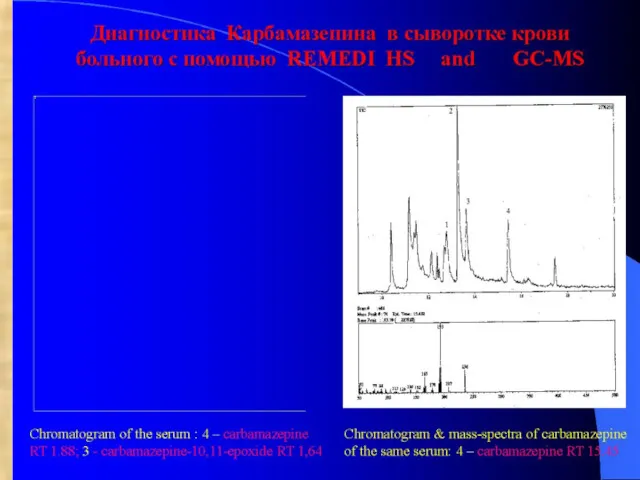
- 47. Определение клозапина в сыворотке крови больного с использованием ВЭЖХ-УФ (REMEDI) и GC-MS Chromatogram of the serum
- 48. Карбамазепин (финлепсин, тагретол) Биодоступность при пероральном приеме 60-85% Связь с белками плазмы 65-95% Т1/2 30-40 час,
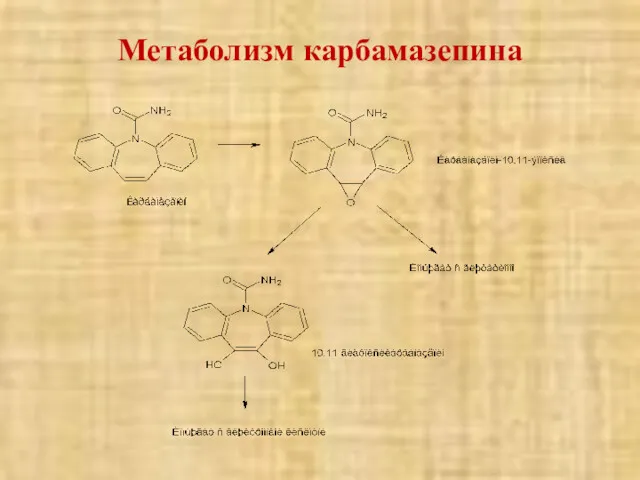
- 49. Метаболизм карбамазепина
- 50. Качественный и количественный анализ карбамазепина Экстракция при рН 8-9. Обнаруживается во фракциях веществ кислого и основного
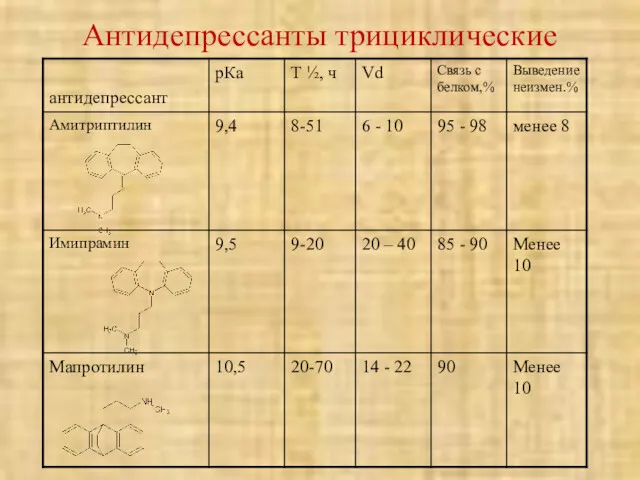
- 52. Антидепрессанты трициклические
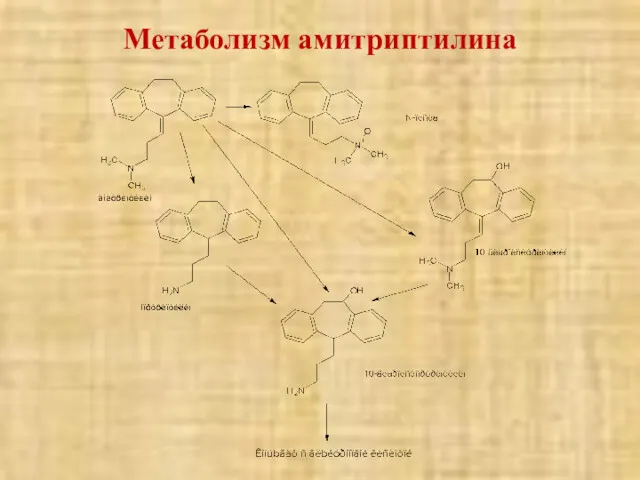
- 54. Метаболизм амитриптилина
- 55. Терапевтические , токсические и летальные концентрации трициклических антидепрессантов в крови
- 56. Качественное исследование амитриптилина ТСХ. Экстракция из мочи при рН = 9 – 10 хлороформом или эфиром.
- 57. Количетвенное определение амитриптилина экстракционно-фотометрический метод по комплексу с бромфеноловым синим после экстракционной и хроматографической очистки. Определяется
- 59. Скачать презентацию


































 Приёмы обращения с лабораторным оборудованием
Приёмы обращения с лабораторным оборудованием Химия биогенных элементов p -блока
Химия биогенных элементов p -блока Периодический закон и периодическая система химических элементов
Периодический закон и периодическая система химических элементов Основные классы неорганических веществ. Соединения химических элементов
Основные классы неорганических веществ. Соединения химических элементов Выделение транс-анетола из эфирных масел
Выделение транс-анетола из эфирных масел Изучение свойств горных пород, минералов и полезных ископаемых
Изучение свойств горных пород, минералов и полезных ископаемых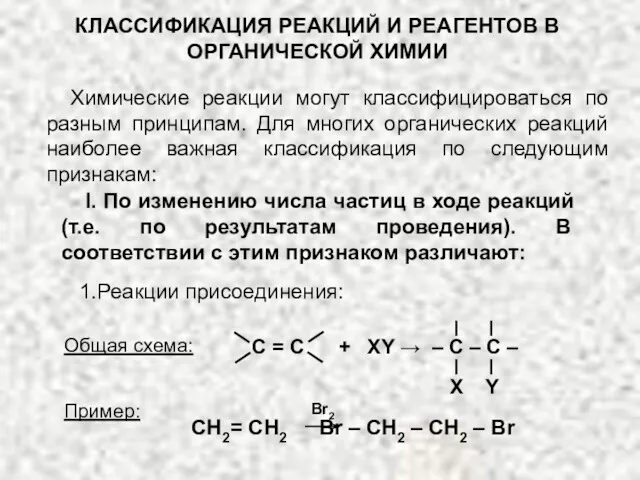 Классификация реакций и реагентов органической химии
Классификация реакций и реагентов органической химии Химическая промышленность
Химическая промышленность Азотсодержащие гетероциклические соединения
Азотсодержащие гетероциклические соединения Химические свойства металлов
Химические свойства металлов Хімічний склад і використання мінералів
Хімічний склад і використання мінералів Химиялық тепе-теңдік және оның ығысуына әсер етуші жағдайлар. Ле Шателье-Браун принциптері
Химиялық тепе-теңдік және оның ығысуына әсер етуші жағдайлар. Ле Шателье-Браун принциптері Окислительно-восстановительные реакции. Лекция 8
Окислительно-восстановительные реакции. Лекция 8 Получение порошков автоклавным осаждением
Получение порошков автоклавным осаждением Обратимость химических реакций. Химическое равновесие и способы его смещения
Обратимость химических реакций. Химическое равновесие и способы его смещения Строение атома
Строение атома Электролиз. Электролизеры
Электролиз. Электролизеры Применение уксусной кислоты
Применение уксусной кислоты Фосфор. Гипофосфатемия и гиперфосфатемия
Фосфор. Гипофосфатемия и гиперфосфатемия Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Розрахунки за хімічними рівняннями
Розрахунки за хімічними рівняннями Установка по переработке углеводородов
Установка по переработке углеводородов Комплексные соединения
Комплексные соединения Физико-химические методы анализа. Лекция 3
Физико-химические методы анализа. Лекция 3 Сера. Аллотропные модификации
Сера. Аллотропные модификации Гидролиз органических и неорганических соединений
Гидролиз органических и неорганических соединений Качественное определение химических элементов в почве
Качественное определение химических элементов в почве Аммиак
Аммиак