Содержание
- 2. Например: или Окислительно-восстановительными называют взаимодействия, связанные с передачей электронов от одних атомов к другим. Окисление металла:
- 3. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ При окислении степень окисления атома увеличивается; при восстановлении – уменьшается.
- 4. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Степень окисления – это формальный заряд атома в молекуле, определенный из предположения ионного
- 5. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Правила определения степени окисления Степень окисления элемента в простом веществе равна нулю: Степень
- 6. Например: В молекуле фосфорной кислоты степень окисления фосфора равна +5, так как три атома водорода со
- 7. Типы окислительно-восстановительных реакций - межмолекулярные реакции, в которых перераспределение электронов происходит между разными веществами: - реакции
- 8. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Методы определения стехиометрических коэффициентов ОВР Метод электронного баланса; 2. Метод полуреакций (электронно-ионного баланса).
- 9. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Пример: Подобрать стехиометрические коэффициенты в ОВР методом электронного баланса: Решение: Составить схему химической
- 10. 5. Написать суммарное уравнение, сложив эти уравнения: 6. Определить ионы, не подвергавшиеся изменению, и составить уравнение
- 11. Внешний вид выполненного задания методом электронного баланса: СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
- 12. Пример подбора коэффициентов методом электронно-ионного баланса: Составить схему химической реакции (написать исходные вещества и продукты реакции):
- 13. 4. Учесть закон электронейтральности, т.е. прировнять число зарядов продуктов реакции числу зарядов исходных веществ. И после
- 14. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ 6. Определить ионы не подвергшиеся изменению в процессе реакции и из совокупности всех
- 15. Внешний вид выполненного задания методом электронно-ионного баланса: СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
- 16. Использование метода полуреакций позволяет: Избежать формального представления о степени окисления; Составить сокращенное уравнение окислительно-восстановительной реакции; Выявить
- 17. Например: Например: Окислитель и восстановитель реагируют между собой в отношении их окислительно-восстановительных эквивалентов. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
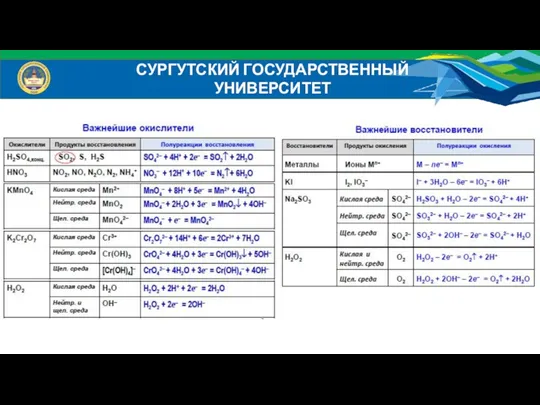
- 18. Эквивалентом окислителя называют такое массовое количество окислителя, которое отвечает одному присоединенному электрону в данной окислительно-восстановительной реакции:
- 19. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
- 20. Количественной характеристикой окислительно-восстановительной активности веществ является электродный или окислительно-восстановительный (восстановительный) потенциал (Е). Окислительно-восстановительный (электродный) потенциал (редокс-потен-циал
- 21. Чем больше стандартный восстановительный потенциал, тем сильнее данное вещество как окислитель и слабее как восстановитель. В
- 22. После преобразования уравнение Нернста принимает вид: Для разбавленных растворов активности могут быть заменены концентрациями: Если стехиометрические
- 23. Для сложных ионов: и для пары уравнение Нернста примет вид: СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
- 24. Рассмотрим на примере: Суммарно: СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
- 25. Для определения самопроизвольности протекания процесса можно определить его электродвижущую силу (э.д.с.), как разность стандартных электродных потенциалов
- 26. Электрохимические процессы Процессы взаимного превращения химической и электрической форм энергии называют электрохимическими процессами. Классификация электрохимических процессов:
- 27. Законы Фарадея 1. Масса выделившегося на электроде вещества пропорциональна количеству прошедшего электричества. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
- 28. 2. Равные количества электричества, прошедшие через раствор электролита, выделяют эквивалентные количества вещества, т.е. при превращении 1
- 29. Если в результате реакции выделяется газ? Например: В результате реакции: при нормальных условиях выделилось 5,6 л
- 30. Стандартные условия, при которых производят сравнение электродных потенциалов: - температура 25 ºС (298 К); давление 101325
- 31. Элемент Даниэля-Якоби СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Рис. 2 Схема медно-цинкового гальвани- ческого элемента Даниэля-Якоби Сравнение стандартных электродных
- 32. Элемент Даниэля-Якоби СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Получаем: Расчет э.д.с.: Положительный знак э.д.с. определяет направление самопроизвольного протекания реакции
- 33. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Связь между энергией Гиббса и электродным (окислительно-восстановительным) потенциалом выражается формулой: Если процесс протекает
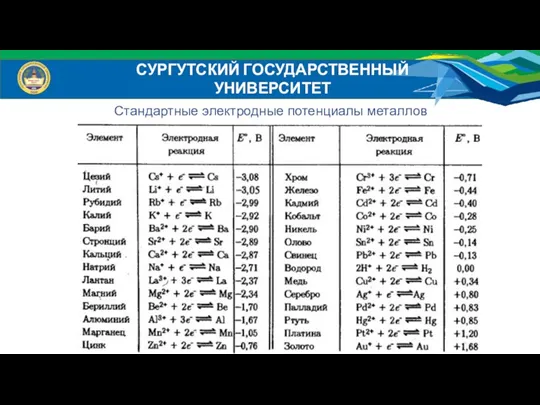
- 34. Стандартные электродные потенциалы металлов СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
- 35. Металлы, обладающие более отрицательным электродным потенциалом, способны вытеснять менее активные металлы (с более положительным потенциалом) из
- 36. Чтобы определить опытным путем потенциал окислительно-восстановительной системы, необходимо составить гальваническую цепь. Например: Определить восстановительный потенциал системы
- 37. Стандартный водородный электрод СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
- 38. Уравнение Нернста: Если концентрации равны, то При увеличении концентрации выше стандартной, электродный потенциал увеличивается (становится более
- 39. Для гальванического элемента: Окислительно-восстановительный (red - ox) процесс состоит из двух полуреакций: Катодный (восстановление): Анодный (окисление):
- 40. В гальванических элементах могут реализоваться два различных электрохимических редокс-взаимодействия: Сами электроды участвуют в окислительно-восстановительной реакции; Например:
- 41. Закономерности в ряду редокс-потенциалов: Если стандартный редокс-потенциал отрицателен, то полуэлемент по отношению к водородному выступает в
- 42. Электролиз - это окислительно-восстановительный процесс, протекающий на электродах под действием электрического тока, проходящего через из раствор
- 43. Электролиз расплава: СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
- 44. Электролиз водных растворов электролитов Катионы металлов, имеющих бо‘льший стандартный электродный потенциал, чем у водорода (от до
- 45. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
- 46. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
- 47. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
- 48. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
- 49. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
- 50. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
- 51. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
- 52. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
- 53. СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
- 55. Скачать презентацию


















































 Элементы группы галогенов
Элементы группы галогенов Химические свойства кислот как электролитов
Химические свойства кислот как электролитов Положение металлов в периодической системе. Металлическая связь. Металлическая решетка. Общие физические свойства металлов
Положение металлов в периодической системе. Металлическая связь. Металлическая решетка. Общие физические свойства металлов Презентация лекция 9 Реактора
Презентация лекция 9 Реактора Три кити нанохімії
Три кити нанохімії Углепластики
Углепластики Растворы. Концентрация растворов
Растворы. Концентрация растворов Арены. Бензол
Арены. Бензол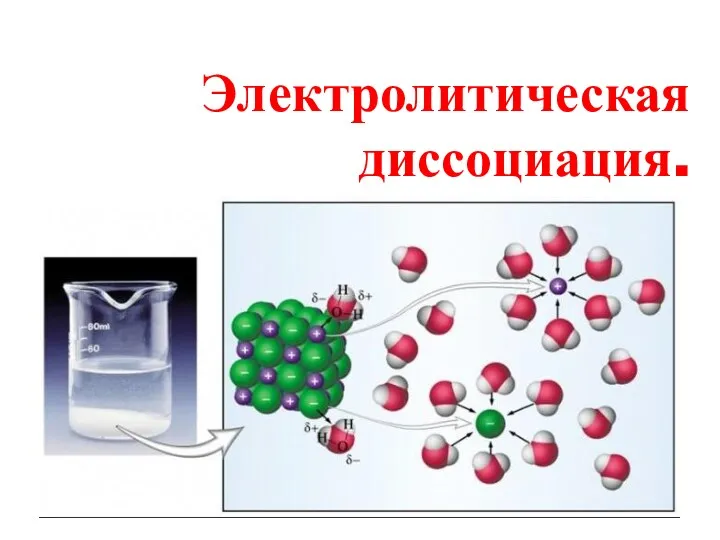 Электролитическая диссоциация
Электролитическая диссоциация Воздушные вяжущие вещества. Гипсоангидритовые вяжущие вещества. Основы процессов схватывания и твердения. (Лекция 1)
Воздушные вяжущие вещества. Гипсоангидритовые вяжущие вещества. Основы процессов схватывания и твердения. (Лекция 1) Розрахункові задачі. Обчислення за хімічними рівняннями. Відносного виходу продукту реакції
Розрахункові задачі. Обчислення за хімічними рівняннями. Відносного виходу продукту реакції Закон сохранения массы вещества
Закон сохранения массы вещества Жесткость воды
Жесткость воды Второе начало термодинамики и его применимость к биосистемам. Химическое равновесие. (Лекция 05)
Второе начало термодинамики и его применимость к биосистемам. Химическое равновесие. (Лекция 05) Химия в решении сырьевой проблемы
Химия в решении сырьевой проблемы Дисахаридтер. Сахароза
Дисахаридтер. Сахароза Комплексонометрия – метод количественного титриметрического анализа
Комплексонометрия – метод количественного титриметрического анализа Материальный баланс химического реактора. Лекция № 3
Материальный баланс химического реактора. Лекция № 3 Склад і властивості нафти
Склад і властивості нафти Поверхностно-активные вещества и их роль
Поверхностно-активные вещества и их роль Методы количественного определения. Химические методы анализа
Методы количественного определения. Химические методы анализа Розв’язування задач за рівняннями реакцій з використанням розчинів із певною масовою часткою розчиненої речовини. Урок 13-14
Розв’язування задач за рівняннями реакцій з використанням розчинів із певною масовою часткою розчиненої речовини. Урок 13-14 Химия и повседневная жизнь человека
Химия и повседневная жизнь человека Основания. Названия оснований
Основания. Названия оснований Обчислення за хімічними рівняннями відносного виходу продукту реакції
Обчислення за хімічними рівняннями відносного виходу продукту реакції Обмен липидов-1
Обмен липидов-1 Химическая реакция. Признаки химической реакции. Химические и нехимические явления
Химическая реакция. Признаки химической реакции. Химические и нехимические явления Классификация и свойства оксидов
Классификация и свойства оксидов