Содержание
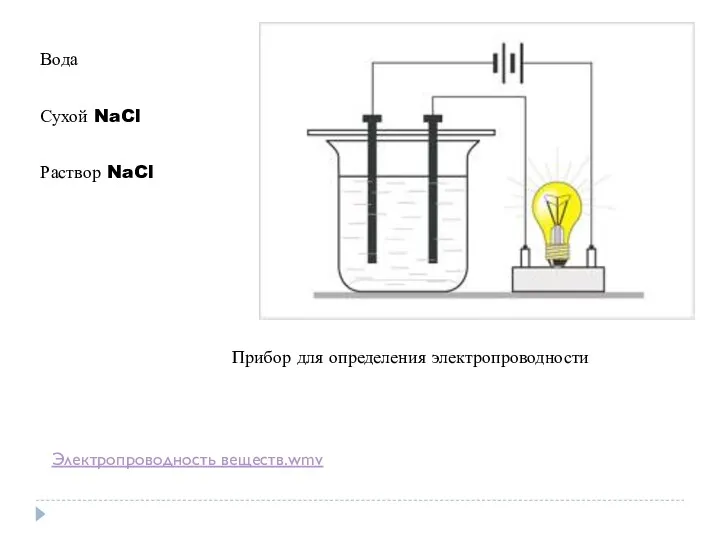
- 2. Прибор для определения электропроводности Вода Сухой NaCl Раствор NaCl Электропроводность веществ.wmv
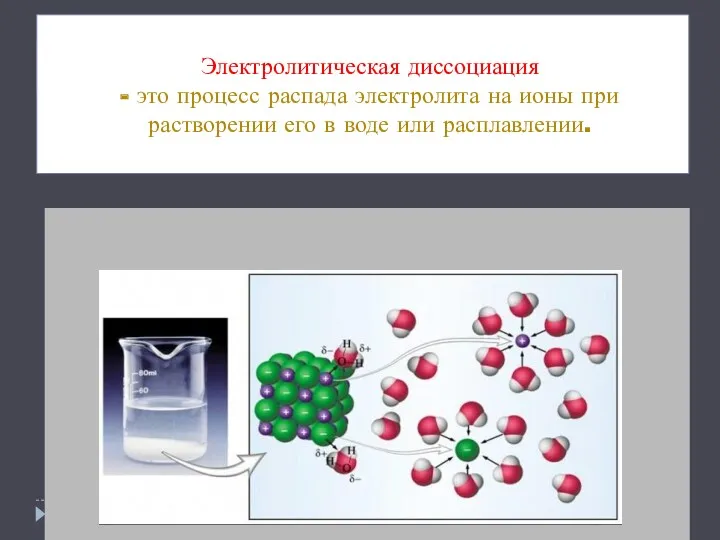
- 3. Электролитическая диссоциация - это процесс распада электролита на ионы при растворении его в воде или расплавлении.
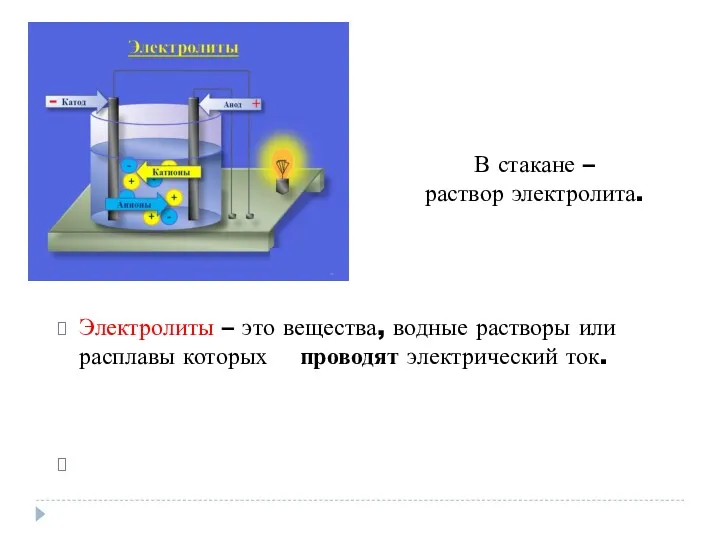
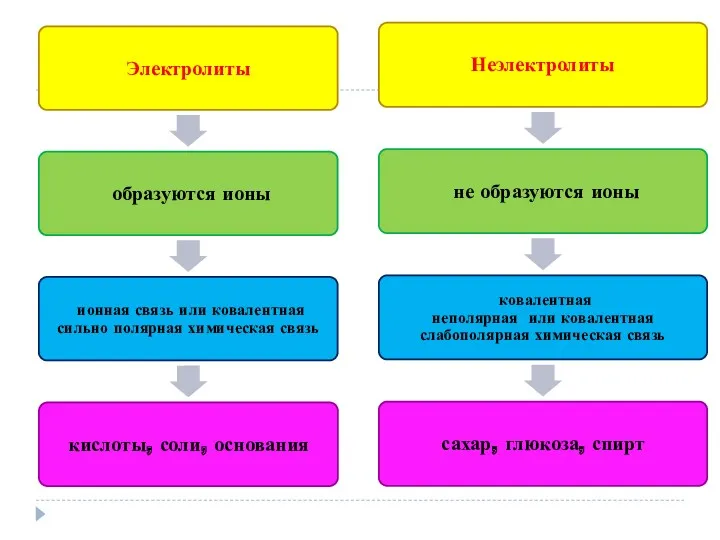
- 4. Электролиты – это вещества, водные растворы или расплавы которых проводят электрический ток. В стакане – раствор
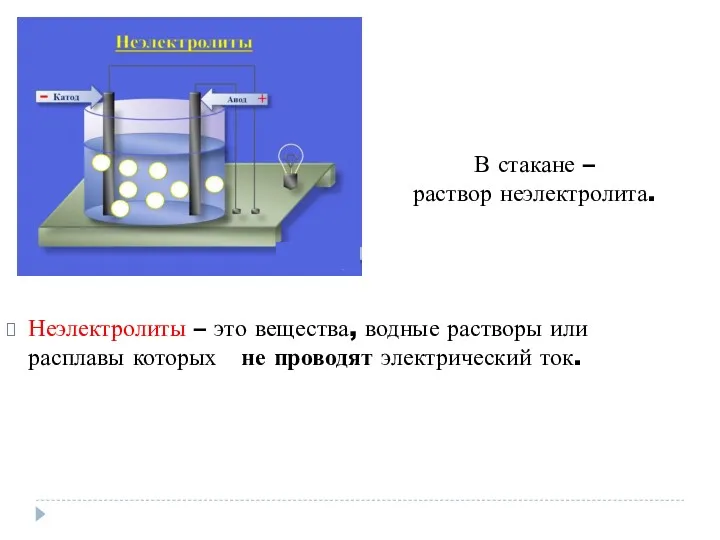
- 5. Неэлектролиты – это вещества, водные растворы или расплавы которых не проводят электрический ток. В стакане –
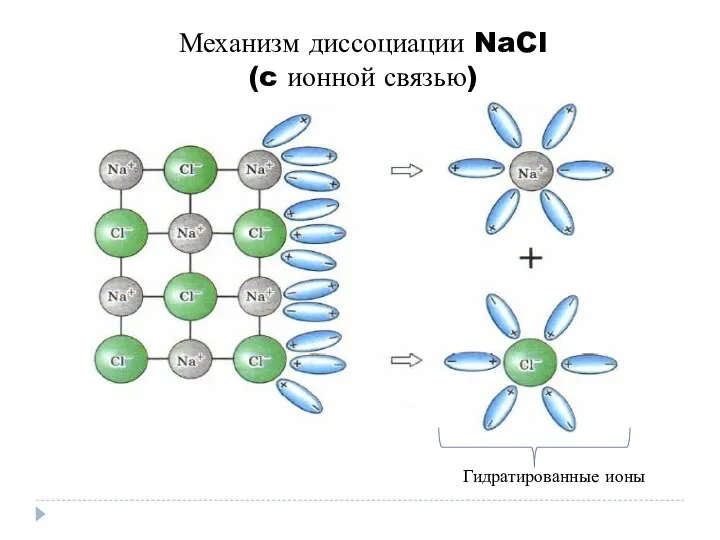
- 7. Механизм диссоциации NaCl (c ионной связью) Гидратированные ионы
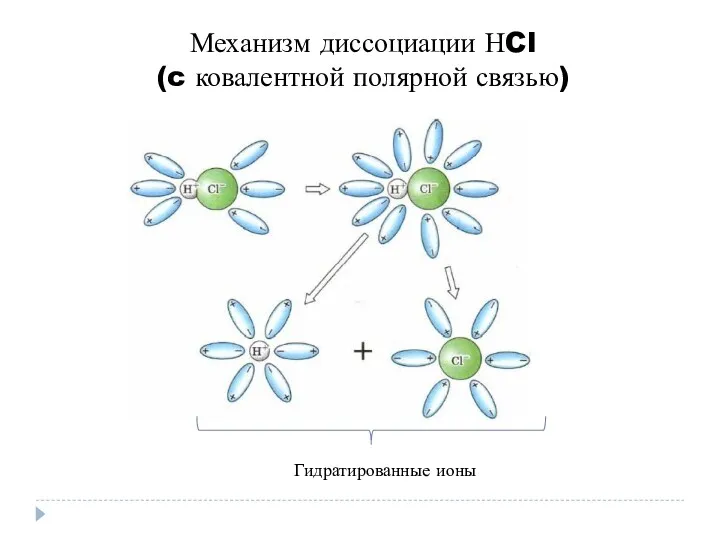
- 8. Механизм диссоциации НCl (c ковалентной полярной связью) Гидратированные ионы
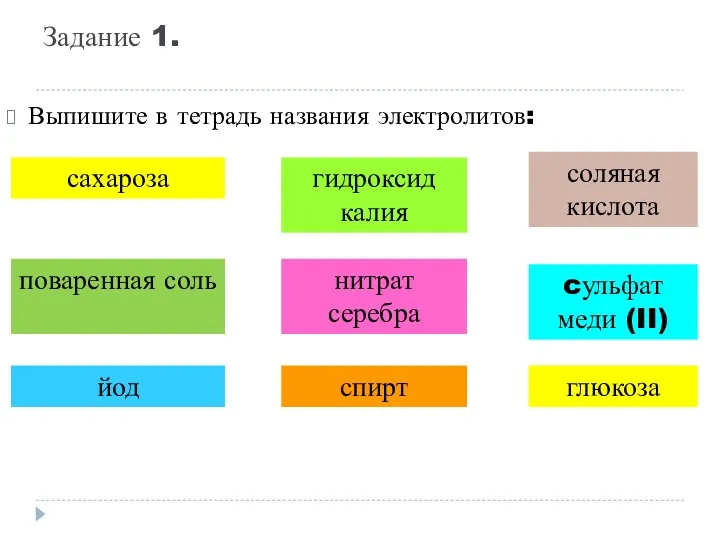
- 9. Задание 1. Выпишите в тетрадь названия электролитов: сахароза поваренная соль гидроксид калия йод нитрат серебра соляная
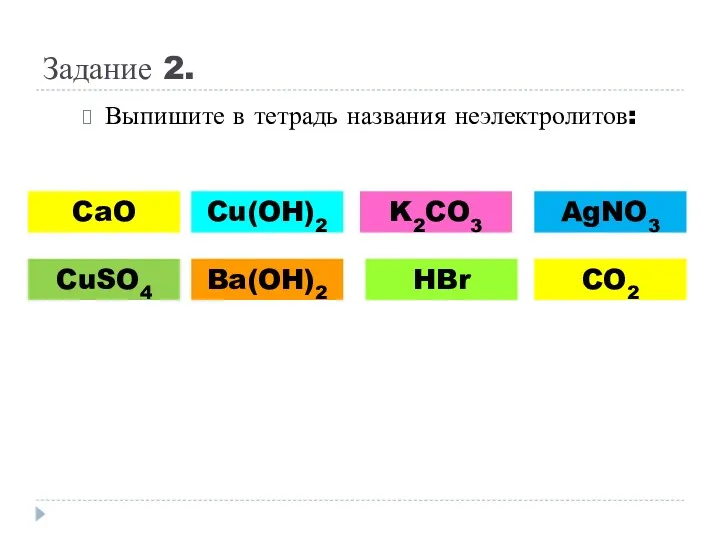
- 10. Задание 2. Выпишите в тетрадь названия неэлектролитов: CaO CuSO4 Cu(OH)2 Ba(OH)2 K2CO3 AgNO3 HBr CO2
- 11. Теория электролитической диссоциации Сванте Аррениус 1) При внесении в воду электролитов в растворе оказываются положительно и
- 12. Диссоциация кислот Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только катионы водорода (H+).
- 13. Диссоциация оснований (щелочей) Основаниями называются электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы (OH
- 14. Диссоциация солей Солями называются электролиты, при диссоциации которых образуются катионы металлов, а также катион аммония (NH4+)
- 15. ЗАДАНИЕ №1. Используя таблицу растворимости солей, кислот, оснований напишите уравнения диссоциации следующих веществ: HF, Mg(OH)2, CaCl2,
- 16. Степень диссоциации α – отношение числа диссоциированных молекул n к общему числу молекул N, находящихся в
- 17. Факторы, влияющие на степень диссоциации: 3. Температура: степень диссоциации возрастает при повышении температуры.
- 18. Электролиты
- 19. Что значит выражение: "Степень диссоциации СН3СООН в растворе равна 0,3"? 30% всех молекул СН3СООН распалась на
- 21. Скачать презентацию









 Химические свойства кислот в свете теории электролитической диссоциации
Химические свойства кислот в свете теории электролитической диссоциации Расчет материального и теплового баланса процесса пиролиза гексана
Расчет материального и теплового баланса процесса пиролиза гексана Активационный анализ
Активационный анализ Бензол қатарындағы гетерофункционалды туындылары дәрі-дәрмек ретінде
Бензол қатарындағы гетерофункционалды туындылары дәрі-дәрмек ретінде Непредельные углеводороды
Непредельные углеводороды Моноядерні арени
Моноядерні арени Титриметрический метод анализа
Титриметрический метод анализа Основы коррозии и защиты металлов
Основы коррозии и защиты металлов Особенности дисперсных систем
Особенности дисперсных систем Решение задачи №4. Старость - на радость. Команда Карбораны
Решение задачи №4. Старость - на радость. Команда Карбораны Сплавы и коррозия металлов
Сплавы и коррозия металлов Основания. Значение оснований
Основания. Значение оснований Салыстырмалы тығыздығы мен элементтердің массалық үлестері бойынша газ күйіндегі заттардың молекулалық формулаларын табу
Салыстырмалы тығыздығы мен элементтердің массалық үлестері бойынша газ күйіндегі заттардың молекулалық формулаларын табу Дослідження методів очищення висококольорових поверхневих вод
Дослідження методів очищення висококольорових поверхневих вод Изменения, происходящие с белками в процессах технологической переработки сырья
Изменения, происходящие с белками в процессах технологической переработки сырья Свинец
Свинец Separation amp confirmation
Separation amp confirmation Количественная характеристика растворов, растворение, растворимость
Количественная характеристика растворов, растворение, растворимость Тепловой эффект химической реакции
Тепловой эффект химической реакции Вода з точки зору хімії
Вода з точки зору хімії Циклоалкандар
Циклоалкандар Основи. Хімія
Основи. Хімія Металлы. Определения. Положение в периодической системе. Металлы в алхимии
Металлы. Определения. Положение в периодической системе. Металлы в алхимии Соли (12 класс)
Соли (12 класс) Крахмал. Строение вещества. Физические и химические свойства
Крахмал. Строение вещества. Физические и химические свойства Гидрокарбонат натрия NaHCO₃
Гидрокарбонат натрия NaHCO₃ Натуральный каучук
Натуральный каучук Требования к осадителю
Требования к осадителю