Содержание
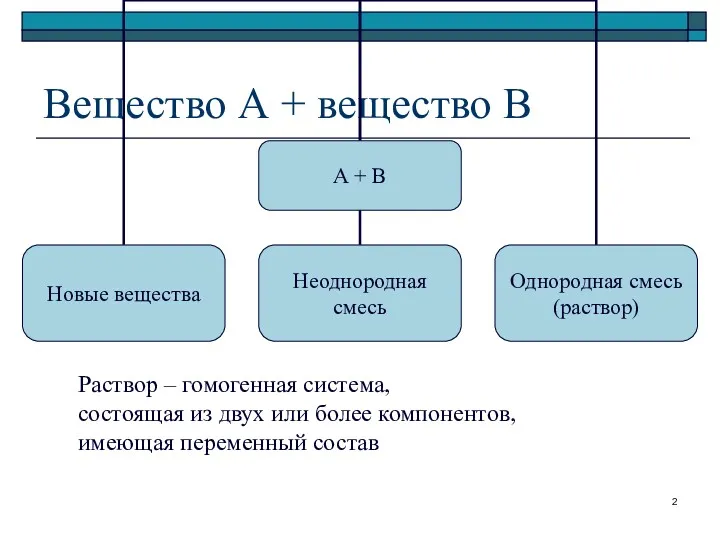
- 2. Вещество А + вещество В Раствор – гомогенная система, состоящая из двух или более компонентов, имеющая
- 3. Смеси веществ Смеси Грубодисперсные системы (взвеси) Тонкодисперсные системы (коллоидные системы) Истинные растворы Размеры частиц более 100
- 4. Истинные растворы Агрегатное состояние: газообразные, жидкие, твердые растворы Состав раствора: растворитель + растворенное вещество Параметры раствора:
- 5. Способы выражения концентрации растворов Массовая доля, (%) Молярная концентрация (молярность), моль/л Эквивалентная концентрация (нормальность), моль/л Мольная
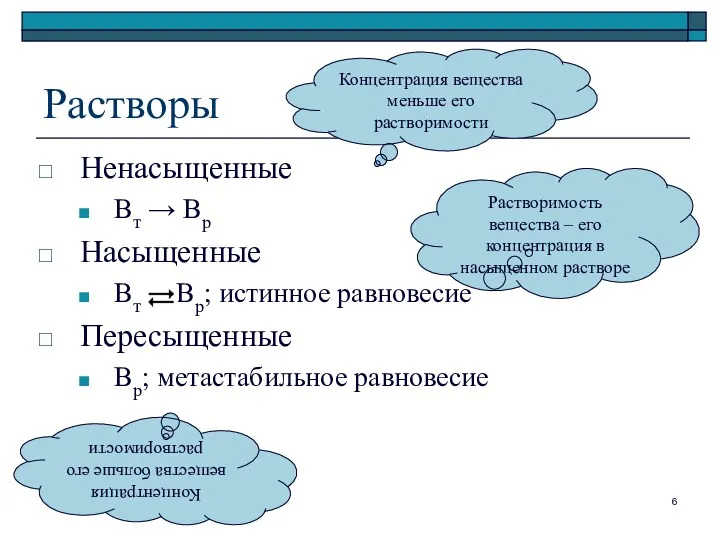
- 6. Растворы Ненасыщенные Вт → Вр Насыщенные Вт Вр; истинное равновесие Пересыщенные Вр; метастабильное равновесие Концентрация вещества
- 7. Растворимость газов в жидкостях Если нет химического взаимодействия Ar(г) Ar(р) Влияние давления ΔV = −1 Увеличение
- 8. Растворимость газов в жидкостях Влияние температуры Qразрыв связей ≈ 0 Qобразование связей > 0 Процесс экзотермический
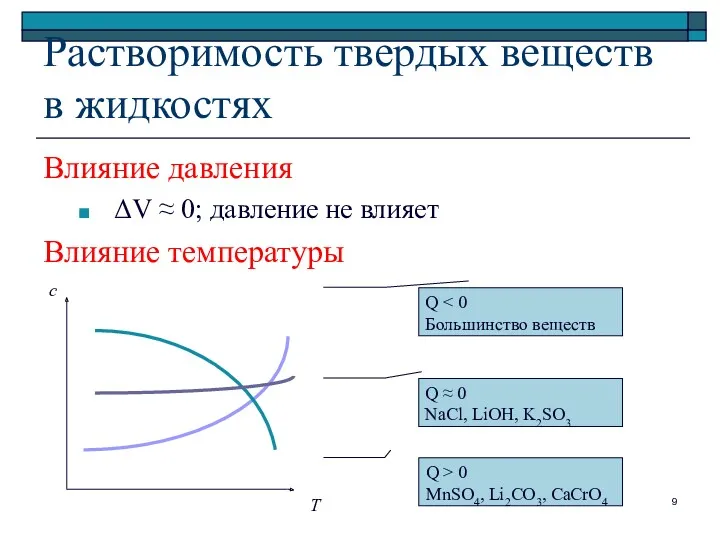
- 9. Растворимость твердых веществ в жидкостях Влияние давления ΔV ≈ 0; давление не влияет Влияние температуры Т
- 10. Растворы электролитов Электролитическая диссоциация
- 11. Степень диссоциации - отношение количества электролита, распавшегося на ионы, к общему количеству растворенного электролита: α0 =
- 12. Сильные электролиты MA → M+(р) + A–(р) [MA] = 0, [M+] = [A–] = c0 Степень
- 13. Слабые электролиты MA → MA(р) + M+(р) + A–(р) [MA] > 0, [M+] = [A–] Степень
- 14. Слабые электролиты MxAy(р) x Ma+(р) + y Ab–(р) Константа диссоциации KD :
- 15. Слабые многоосновные кислоты и слабые многокислотные основания диссоциируют в несколько этапов ( ступенчато ): I cтупень:Н2СО3
- 16. Закон разбавления Оствальда МА М+ + А– [M+] [A–] KD = ––––––––– [MA] [M+] = [A–]
- 17. Классическая теория кислот и оснований Аррениуса.
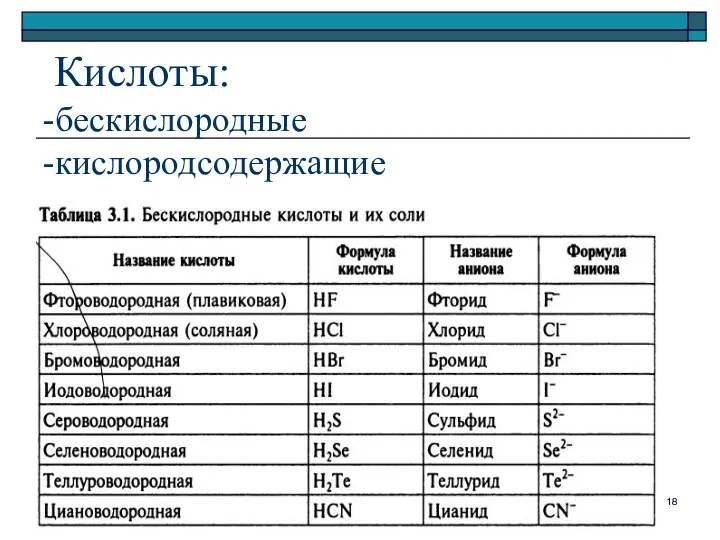
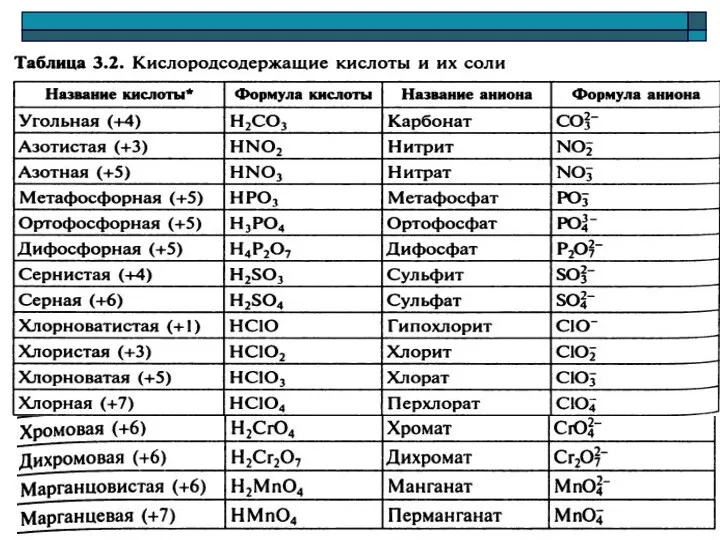
- 18. Кислоты: -бескислородные -кислородсодержащие
- 20. Основания
- 21. Протолитическая теория кислот и оснований 1923 г. Йоханес Брёнстед Томас Лаури
- 22. В 1923 г. И. Бренстед и Т. Лоури предложили общую протолитическую теорию кислот и оснований. Кислота
- 23. Амфолиты — молекулы или ионы, способные как отдавать, так и присоединять протон, а следовательно, вступать в
- 24. кислотные или основные свойства частиц обусловлены их способностью отдавать или присоединять катион водорода (протон Н+) Н+
- 25. Растворители Апротонные: C6H6, CS2, CCl4 Протонные H2O, NH3, C2H5OH (амфолиты) Автопротолиз: HL + HL H2L+ +
- 26. Ионное произведение воды H2O + H2O H3O+ + OH– При стандартной температуре 298 К (25 °С):
- 27. Водородный показатель (рН) рН = –lg[H+] [H+] = 10–рН Гидроксидный показатель (рОН) pOH = –lg[OH–] [OH–]
- 28. Водородный показатель (рН) В чистой воде при 25°С рН = рОН = 7 Среда нейтральная Если
- 29. Шкала рН При [H+] = 0,1 моль/л (например, в 0,1 М растворе HCl) pH = 1
- 31. Скачать презентацию







![Сильные электролиты MA → M+(р) + A–(р) [MA] = 0,](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/257796/slide-11.jpg)
![Слабые электролиты MA → MA(р) + M+(р) + A–(р) [MA]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/257796/slide-12.jpg)


![Закон разбавления Оствальда МА М+ + А– [M+] [A–] KD](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/257796/slide-15.jpg)








![Водородный показатель (рН) рН = –lg[H+] [H+] = 10–рН Гидроксидный](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/257796/slide-26.jpg)

![Шкала рН При [H+] = 0,1 моль/л (например, в 0,1](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/257796/slide-28.jpg)
 Сапалық талдау. Сапалық аналитикалық реакциялар
Сапалық талдау. Сапалық аналитикалық реакциялар Комплексті қосылыстар және олардың биологиялық маңызы
Комплексті қосылыстар және олардың биологиялық маңызы Обчислення швидкості хімічних реакцій в залежності від концентрації реагуючих речовин і температури
Обчислення швидкості хімічних реакцій в залежності від концентрації реагуючих речовин і температури Масса и формулы. Химия 8 класс
Масса и формулы. Химия 8 класс Алкадиены
Алкадиены O-alkylation catalysts
O-alkylation catalysts Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы
Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы Превращение веществ
Превращение веществ Камень чароит
Камень чароит Непредельные углеводороды ряда этилена. Олефины
Непредельные углеводороды ряда этилена. Олефины Спирт. Спирты в природе. Влияние спирта на человека
Спирт. Спирты в природе. Влияние спирта на человека Алюминий и его соединения
Алюминий и его соединения Қатты әсер ететін уландырғыш заттар
Қатты әсер ететін уландырғыш заттар Классы неорганических веществ. Классификация неорганических веществ
Классы неорганических веществ. Классификация неорганических веществ Теория электролитической диссоциации
Теория электролитической диссоциации Основания. 8 класс
Основания. 8 класс Химическая связь. Виды химической связи
Химическая связь. Виды химической связи Карбонові кислоти. Хімія. 9 клас
Карбонові кислоти. Хімія. 9 клас Алкадиены. Непредельные углеводороды
Алкадиены. Непредельные углеводороды Методы разделения и исследования состава нефти и газа
Методы разделения и исследования состава нефти и газа Карбонильные соединения
Карбонильные соединения Особенности организации обучения химии в рамках компетентностно-ориентированной модели образования
Особенности организации обучения химии в рамках компетентностно-ориентированной модели образования Химическая промышленность. Минеральные удобрения
Химическая промышленность. Минеральные удобрения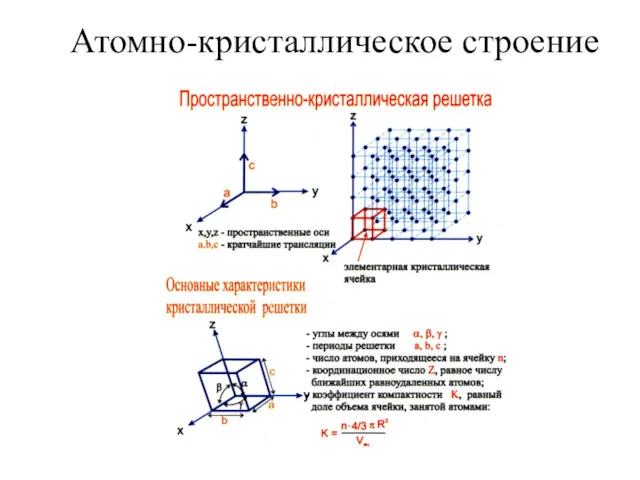 Атомно-кристаллическое строение
Атомно-кристаллическое строение Углеводороды из Башкортостана
Углеводороды из Башкортостана Классификация органических соединений. Углеводороды
Классификация органических соединений. Углеводороды Окислительно-восстановительные реакции. 11 класс
Окислительно-восстановительные реакции. 11 класс Катионы 1, 2 аналитических групп
Катионы 1, 2 аналитических групп