Содержание
- 2. Электролитическая диссоциация — это процесс распада электролита на ионы.
- 3. При растворении в воде электролиты диссоциируют (распадаются) на положительные и отрицательные ионы. Теория электролитической диссоциации
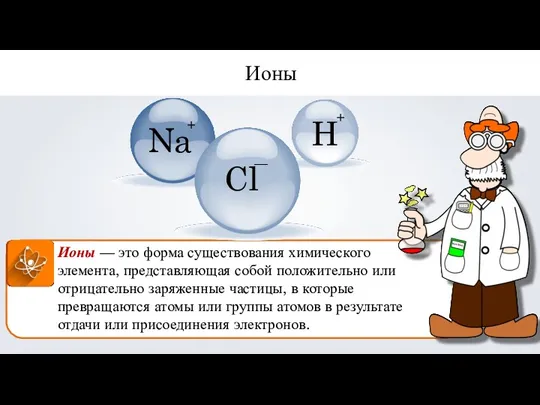
- 4. Ионы — это форма существования химического элемента, представляющая собой положительно или отрицательно заряженные частицы, в которые
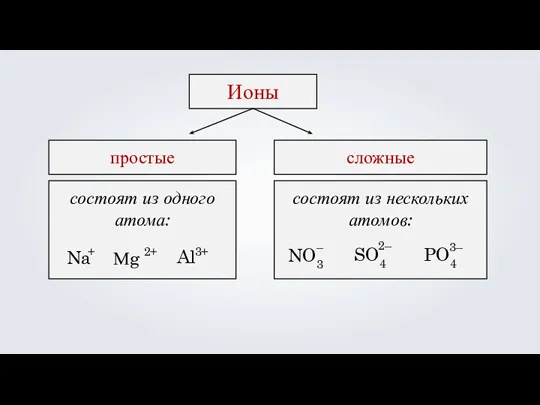
- 5. состоят из одного атома: Ионы простые сложные состоят из нескольких атомов:
- 6. MnO4 CrO4 – 2–
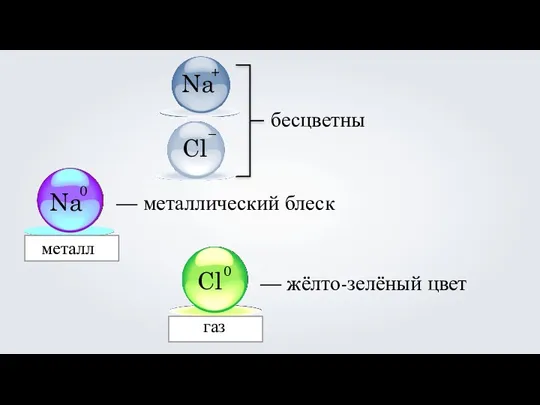
- 7. Na Cl + – бесцветны Na 0 — металлический блеск металл 0 — жёлто-зелёный цвет Cl
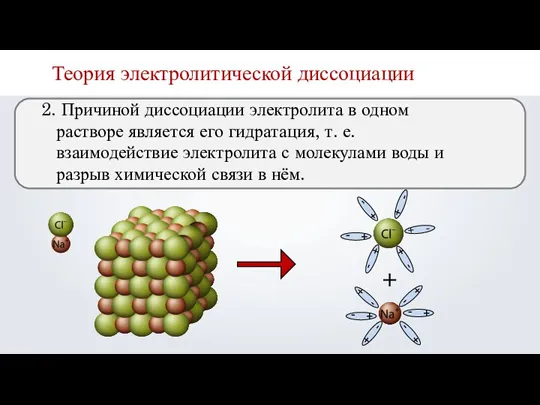
- 8. 2. Причиной диссоциации электролита в одном растворе является его гидратация, т. е. взаимодействие электролита с молекулами
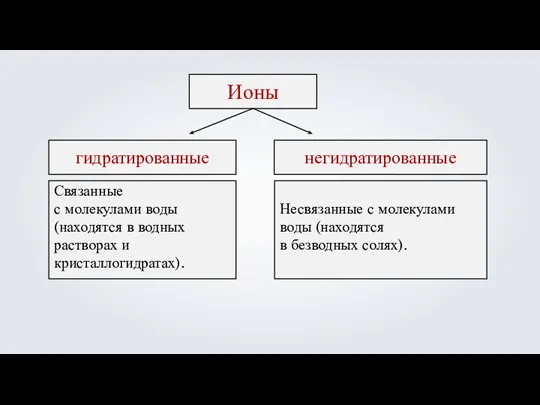
- 9. Связанные с молекулами воды (находятся в водных растворах и кристаллогидратах). Ионы гидратированные негидратированные Несвязанные с молекулами
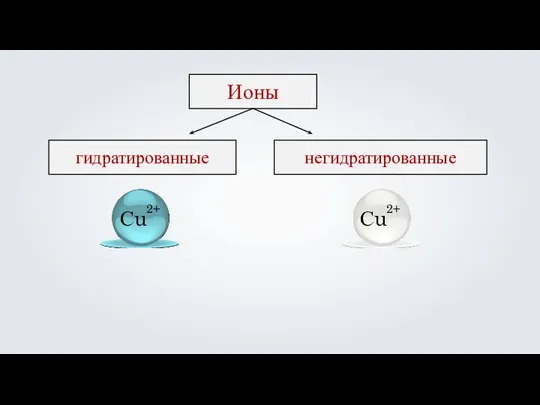
- 10. Ионы гидратированные негидратированные Сu 2+ Сu 2+
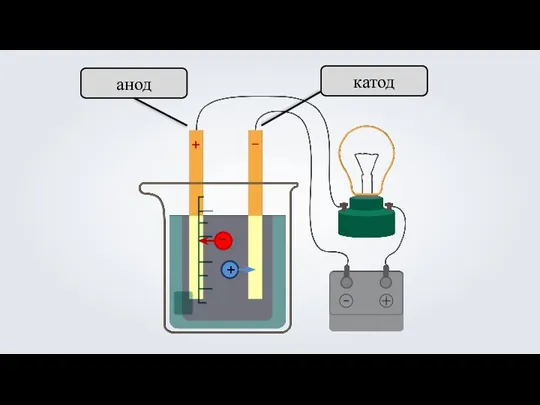
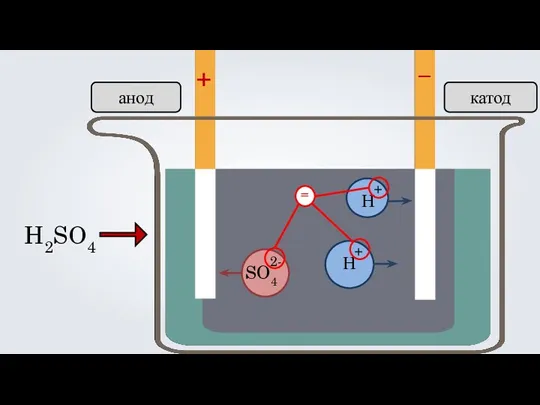
- 11. 3. Под действием электрического тока, положительно заряженные ионы движутся к отрицательно заряженному полюсу источника тока —
- 12. анод катод + –
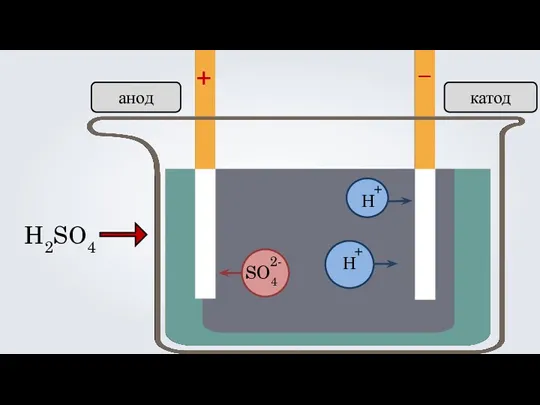
- 13. + – H2SO4 Н Н анод катод SO4 + + 2-
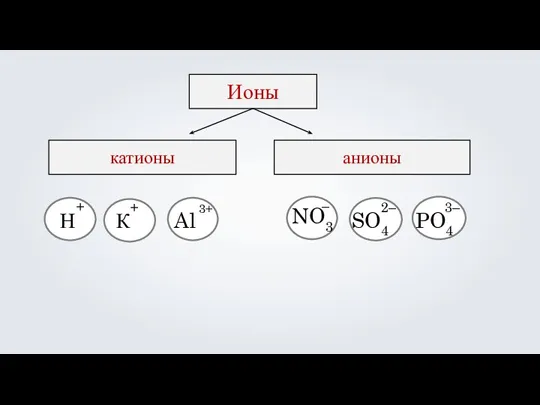
- 14. Ионы катионы анионы Н К Al NO3 – SO4 2– PO4 3– + + 3+
- 15. + – H2SO4 Н Н анод катод SO4 + + 2- =
- 16. Теория электролитической диссоциации 4. Электролитическая диссоциация — процесс обратимый для слабых электролитов. Н2СО3 2Н + СО3
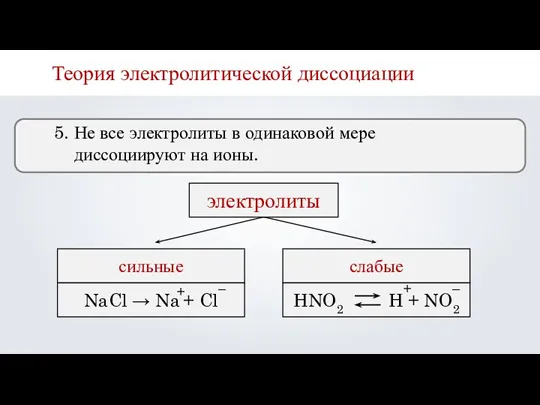
- 17. Теория электролитической диссоциации 5. Не все электролиты в одинаковой мере диссоциируют на ионы. электролиты сильные слабые
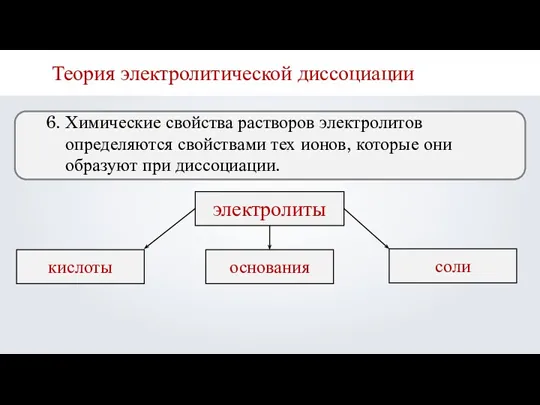
- 18. Теория электролитической диссоциации 6. Химические свойства растворов электролитов определяются свойствами тех ионов, которые они образуют при
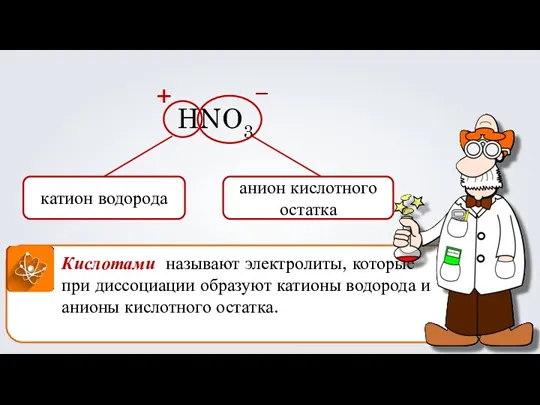
- 19. Кислотами называют электролиты, которые при диссоциации образуют катионы водорода и анионы кислотного остатка. HNO3 катион водорода
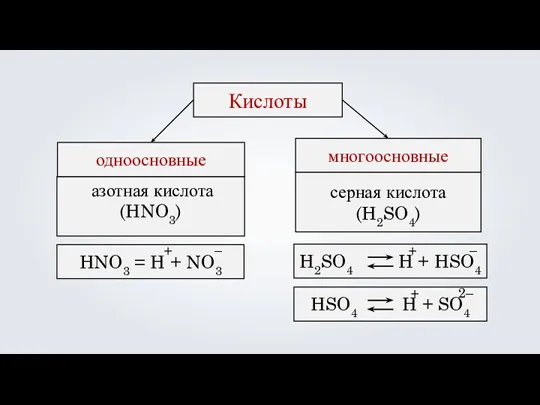
- 20. Кислоты одноосновные многоосновные HNO3 = H + NO3 + – H2SO4 H + HSO4 + –
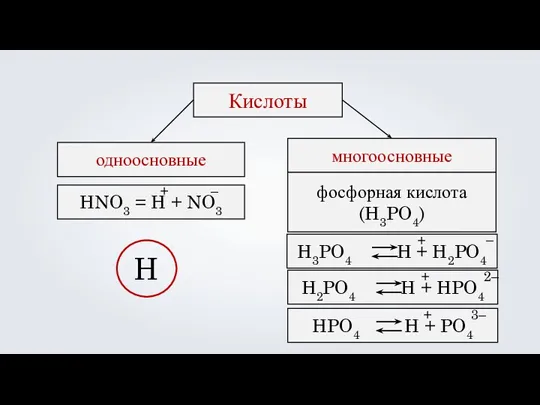
- 21. Кислоты одноосновные многоосновные HNO3 = H + NO3 + – H3PO4 H + H2PO4 + –
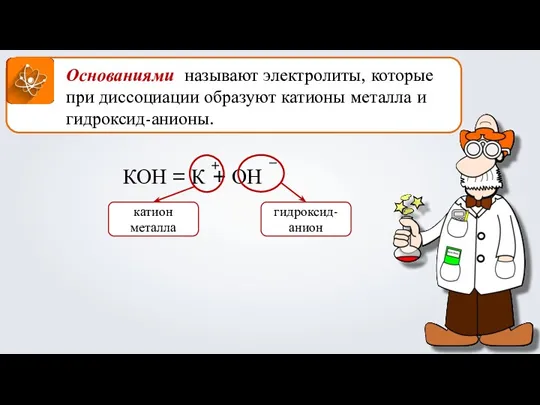
- 22. Основаниями называют электролиты, которые при диссоциации образуют катионы металла и гидроксид-анионы. КОН = К + ОН
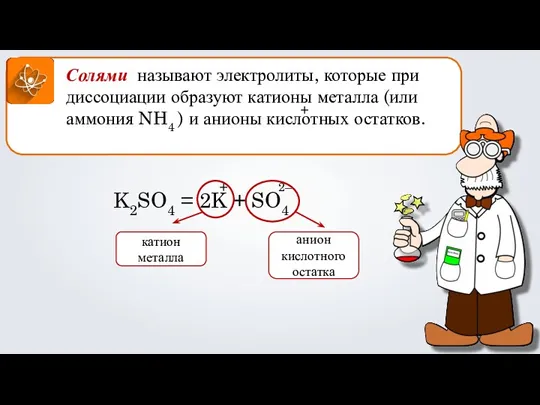
- 23. Солями называют электролиты, которые при диссоциации образуют катионы металла (или аммония NH4 ) и анионы кислотных
- 25. Скачать презентацию





 Uses of chlorine and its compounds
Uses of chlorine and its compounds Кислоты: классификация и химические свойства
Кислоты: классификация и химические свойства Альдегіди. Карбонові кислоти. Одержання. Фізичні та хімічні властивості
Альдегіди. Карбонові кислоти. Одержання. Фізичні та хімічні властивості XXI ғасыр көшбасшысы
XXI ғасыр көшбасшысы Понятия про синтетические лекарственные средства
Понятия про синтетические лекарственные средства Класифікація хімічних реакцій за кількістю і складом реагентів та продуктів реакції. 9 клас
Класифікація хімічних реакцій за кількістю і складом реагентів та продуктів реакції. 9 клас Коррозия металлов. Классификация коррозионных процессов
Коррозия металлов. Классификация коррозионных процессов Алкины. Строение алкинов
Алкины. Строение алкинов Происхождение рибосомы, белкового синтеза и генетического кода
Происхождение рибосомы, белкового синтеза и генетического кода Лекция как один из методов обучения химии на старшей ступени общего образования. Методика ее подготовки и чтения
Лекция как один из методов обучения химии на старшей ступени общего образования. Методика ее подготовки и чтения Необоротні і оборотні хімічні процеси. Хімічна рівновага
Необоротні і оборотні хімічні процеси. Хімічна рівновага Мини-проект по дисциплине: Физико-химические методы исследования и техника лабораторных работ
Мини-проект по дисциплине: Физико-химические методы исследования и техника лабораторных работ Смолы и бальзамы. Воски и структурообразующие вещества в косметическом производстве
Смолы и бальзамы. Воски и структурообразующие вещества в косметическом производстве Моторные масла
Моторные масла Группа веществ, изолируемых полярными растворителями
Группа веществ, изолируемых полярными растворителями Перспективная модель ОГЭ-2020 по химии
Перспективная модель ОГЭ-2020 по химии Цепные химические реакции
Цепные химические реакции Застосування засобів захисту органів дихання від небезпечних хімічних речовин
Застосування засобів захисту органів дихання від небезпечних хімічних речовин Кристаллическое строение и кристаллизация металлов
Кристаллическое строение и кристаллизация металлов Натуральный и синтетический каучуки. Резина
Натуральный и синтетический каучуки. Резина Альдегиды и кетоны. Определение
Альдегиды и кетоны. Определение Классификация химических элементов
Классификация химических элементов Гидролиз. Классификация солей
Гидролиз. Классификация солей Неметаллы
Неметаллы Сложные эфиры. Жиры
Сложные эфиры. Жиры Приемы обращения с лабораторным оборудованием
Приемы обращения с лабораторным оборудованием Электроотрицательность химических элементов
Электроотрицательность химических элементов Химическая технология природных энергоносителей и углеродных материалов
Химическая технология природных энергоносителей и углеродных материалов