Содержание
- 3. Гидролиз — это реакция обменного разложения веществ водой.
- 4. Классификация солей соли 1 тип: образованы сильным основанием и сильной кислотой KNO3, Na2SO4, … 2 тип:
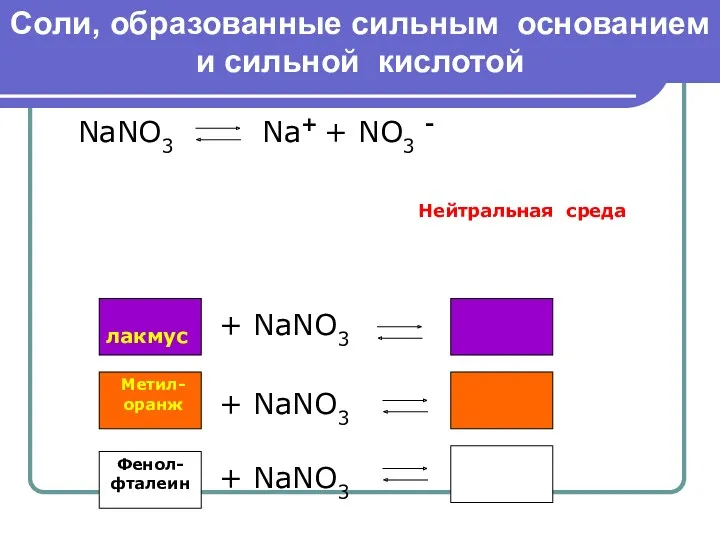
- 5. Соли, образованные сильным основанием и сильной кислотой NaNO3 Na+ + NO3 - Нейтральная среда лакмус +
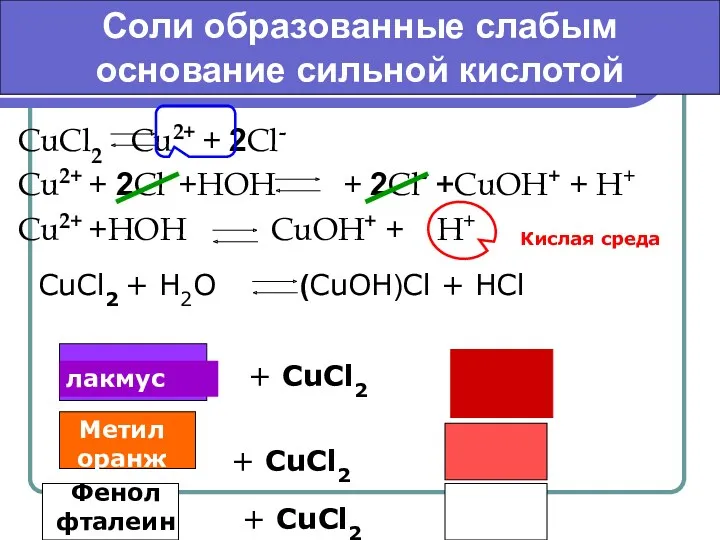
- 6. CuCl2 Cu2+ + 2Cl- Cu2+ + 2Cl- +HOH + 2Cl- +CuOH+ + H+ Cu2+ +HOH CuOH+
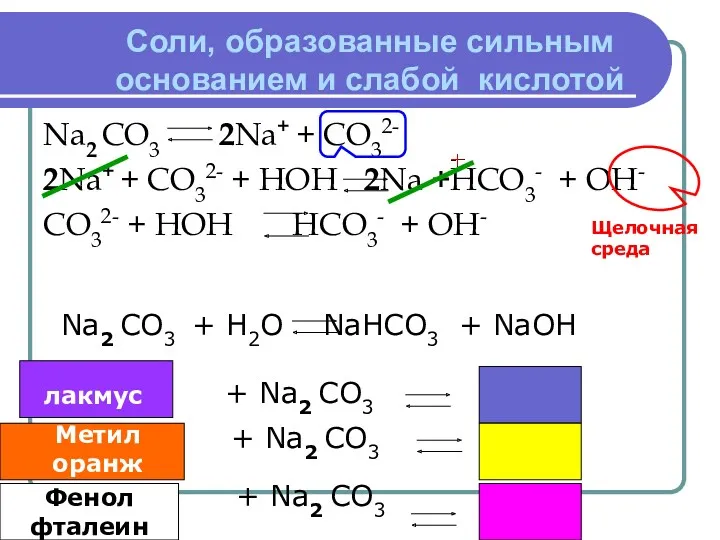
- 7. Соли, образованные сильным основанием и слабой кислотой Na2 CO3 2Na+ + CO32- 2Na+ + CO32- +
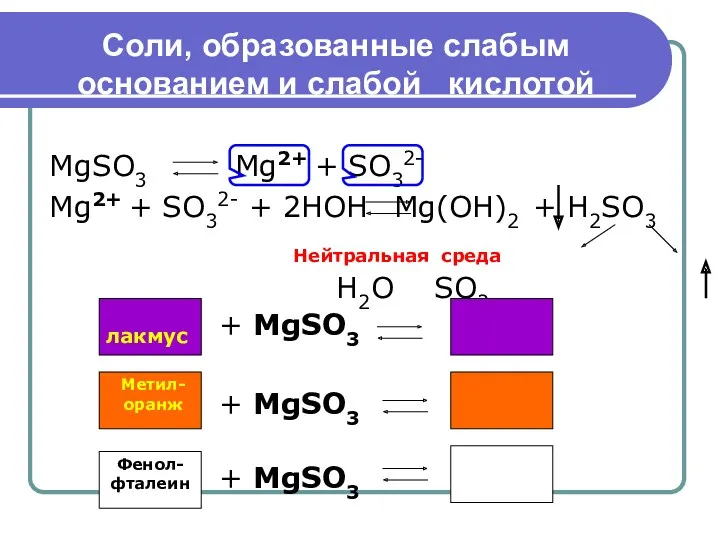
- 8. Соли, образованные слабым основанием и слабой кислотой MgSO3 Mg2+ + SO32- Mg2+ + SO32- + 2HOH
- 9. Проверь себя Задание 2: Определите окраску лакмуса в растворах солей: Ba(NO3)2, FeCl3, LiNO2, CoSO4, Na2SiO3, ZnS,
- 10. Проверь себя Задание 3: Исключите лишнюю соль из списка: А) ZnCl2, CuSO4, KNO3, Ni(NO3)2 Б) K2S,
- 11. Гидролиз органических веществ. 1. Гидролиз галогеналканов. С2Н5Сl + Н2О →С2Н5ОН + НСl 2. Гидролиз сложных эфиров.
- 13. Скачать презентацию






 Предмет и объекты исследования коллоидной химии. Лекция 01
Предмет и объекты исследования коллоидной химии. Лекция 01 Промышленное производство аммиака
Промышленное производство аммиака Rates of reaction
Rates of reaction Алюминий и его сплавы
Алюминий и его сплавы Алкины. Самостоятельная работа
Алкины. Самостоятельная работа Тепловой эффект химической реакции. Топливо. Водород. 8 класс
Тепловой эффект химической реакции. Топливо. Водород. 8 класс Химические свойства основных классов неорганических соединений
Химические свойства основных классов неорганических соединений Бензен. Номенклатура. Хімічні властивості
Бензен. Номенклатура. Хімічні властивості Химические уравнения
Химические уравнения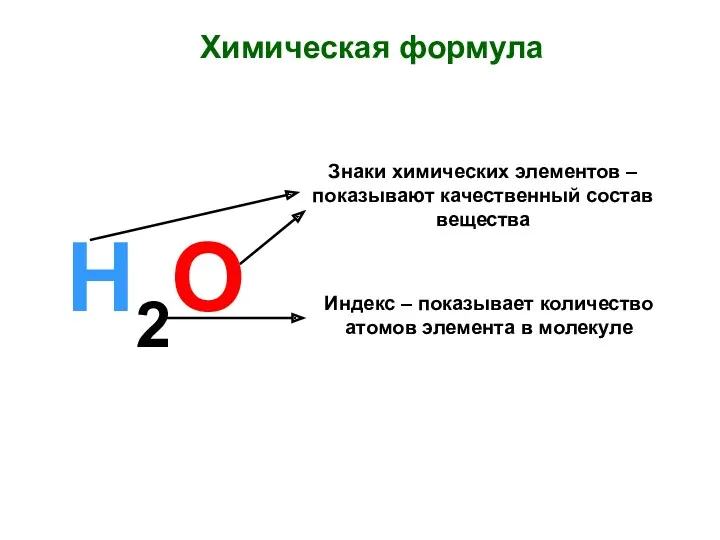 Химическая формула. Знаки химических элементов
Химическая формула. Знаки химических элементов История открытия периодической системы химических элементов Д.И. Менделеева
История открытия периодической системы химических элементов Д.И. Менделеева An introduction to the chemistry of alkenes
An introduction to the chemistry of alkenes Химия. Отличие химических свойств от физических
Химия. Отличие химических свойств от физических Ертінділер. Ерітінді концентрациясын білдіру тәсілдері
Ертінділер. Ерітінді концентрациясын білдіру тәсілдері Хлороводород..Соляная кислота
Хлороводород..Соляная кислота Закон сохранения массы веществ
Закон сохранения массы веществ Дисперсные системы
Дисперсные системы Производство чугуна и стали
Производство чугуна и стали Характеристика строения и свойств химических элементов
Характеристика строения и свойств химических элементов Лигандообменные равновесия и процессы. Строение комплексных соединений
Лигандообменные равновесия и процессы. Строение комплексных соединений Физические явления – основа разделения смесей в химии (урок химии в 8 классе)
Физические явления – основа разделения смесей в химии (урок химии в 8 классе) Хлороводород. Соляная кислота
Хлороводород. Соляная кислота Окисление и восстановление
Окисление и восстановление Классификация химических реакций
Классификация химических реакций Основания. Состав, классификация, свойства, получение
Основания. Состав, классификация, свойства, получение Водород, получение, свойства и применение
Водород, получение, свойства и применение Швидкість та механізм хімічних реакцій. Каталіз. Хімічна рівновага
Швидкість та механізм хімічних реакцій. Каталіз. Хімічна рівновага Оборотні і необоротні реакції. Хімічна рівновага
Оборотні і необоротні реакції. Хімічна рівновага