Слайд 2

Слайд 3

Хлороводород HCl
HCl – это бесцветный газ с резким неприятным запахом, тяжелее
воздуха.
Докажем это:
М (HCl)= 1+35,5=36,5 г/моль
М (воздуха)= 29 г/моль
Слайд 4
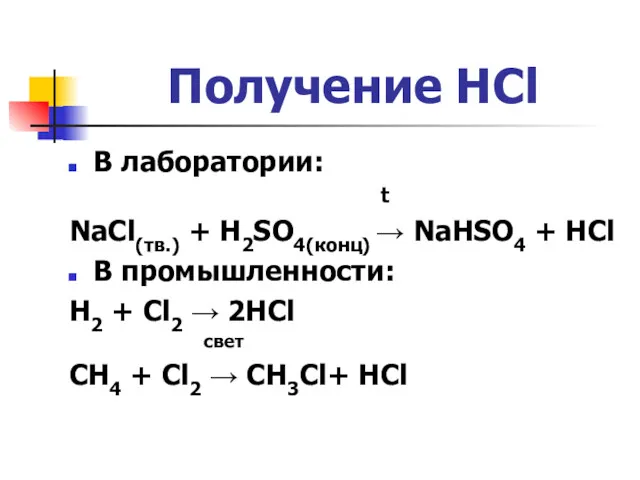
Получение HCl
В лаборатории:
t
NaCl(тв.) + H2SO4(конц) → NaHSO4 + HCl
В промышленности:
H2
+ Cl2 → 2HCl
свет
CH4 + Cl2 → CH3Cl+ HCl
Слайд 5

Соляная кислота HCl
Соляная кислота сильная, т.е. в водных растворах полностью распадается
на ионы:
HCl → H+ + Cl-
Растворы кислоты не имеют запаха.
Слайд 6
Слайд 7

Слайд 8

Химические свойства
Кислотные свойства
А. Взаимодействие с металлами, стоящими в ряду активности до
водорода:
HCl + Zn →
2HCl + Zn → ZnCl2 + H2
Допишите:
HCl + Al →
Слайд 9
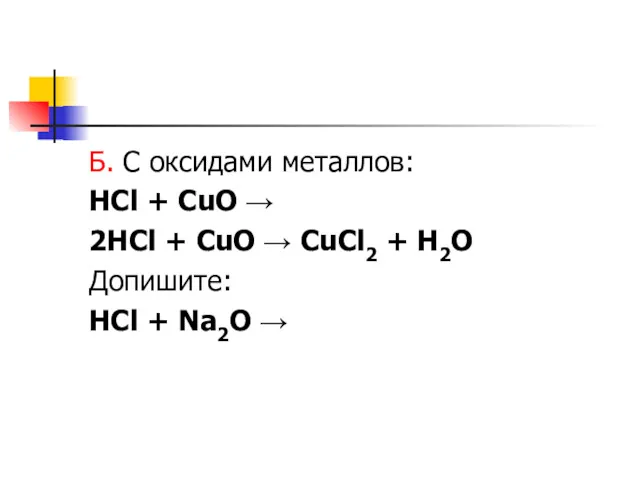
Б. С оксидами металлов:
HCl + CuO →
2HCl + CuO →
CuCl2 + H2O
Допишите:
HCl + Na2O →
Слайд 10
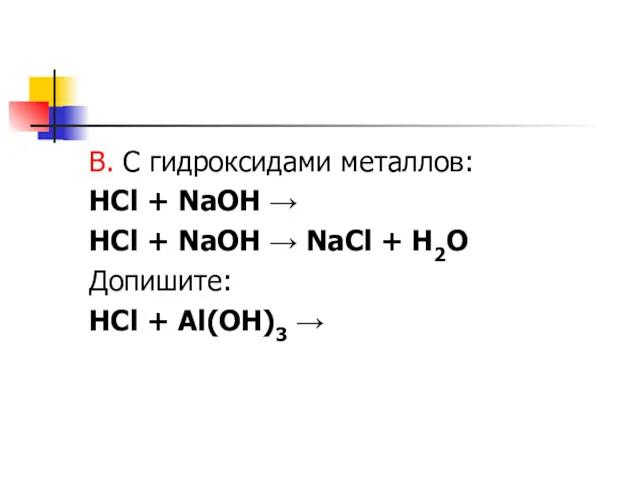
В. С гидроксидами металлов:
HCl + NaOH →
HCl + NaOH →
NaCl + H2O
Допишите:
HCl + Al(OH)3 →
Слайд 11
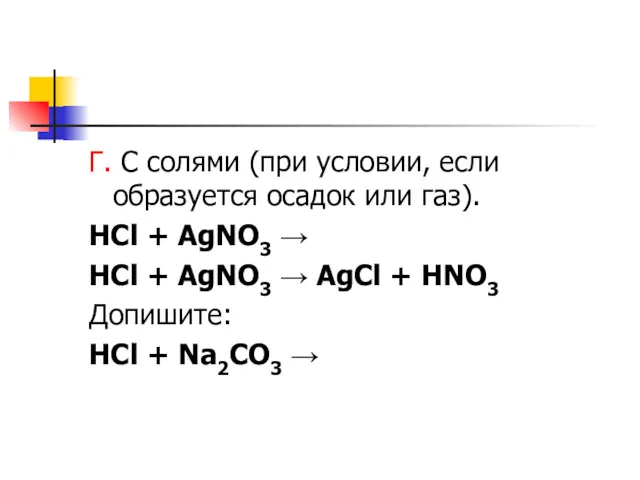
Г. С солями (при условии, если образуется осадок или газ).
HCl +
AgNO3 →
HCl + AgNO3 → AgCl + HNO3
Допишите:
HCl + Na2CO3 →
Слайд 12

2. Восстановительные свойства.
HCl + MnO2 → MnCl2 + Cl2 + 2H2O
HCl
+ KMnO4 → MnCl2 + Cl2 + KCl + H2O
HCl + KClO3 → Cl2 + KCl + H2O
В данных уравнениях расставьте коэффициенты с помощью электронного баланса, определите кто является окислителем, а кто – восстановителем.











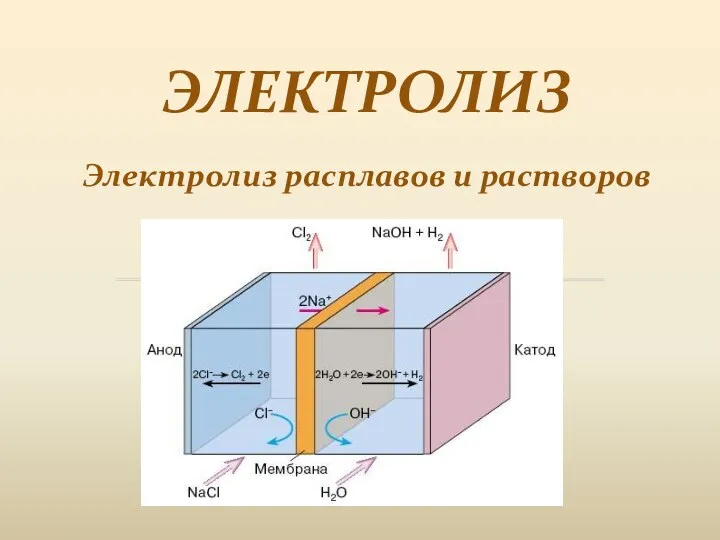 Электролиз. Электролиз расплавов и растворов
Электролиз. Электролиз расплавов и растворов Алифатические углеводороды: алканы, алкены, алкины
Алифатические углеводороды: алканы, алкены, алкины Реакции окисления и восстановления органических соединений
Реакции окисления и восстановления органических соединений Химические свойства простых металлов, неметаллов и оксидов. Задание 6 по ЕГЭ
Химические свойства простых металлов, неметаллов и оксидов. Задание 6 по ЕГЭ Предельные углеводороды. Насыщенные алифатические углеводороды. Алканы или Парафины
Предельные углеводороды. Насыщенные алифатические углеводороды. Алканы или Парафины Альдегиды и кетоны
Альдегиды и кетоны Свойства растворов электролитов
Свойства растворов электролитов Кислотно-основное титрование
Кислотно-основное титрование Растворы и растворимость. (8 класс)
Растворы и растворимость. (8 класс) Классификация и номенклатура неорганических веществ
Классификация и номенклатура неорганических веществ Соли
Соли Основные классы неорганических соединений
Основные классы неорганических соединений Переработка нефти. Крекинг
Переработка нефти. Крекинг Химические свойства солей
Химические свойства солей Изучение свойств тиосульфата натрия
Изучение свойств тиосульфата натрия АЛКАНЫ Строение молекулы метана.
АЛКАНЫ Строение молекулы метана. Адсорбция на пористых адсорбентах. Пористость. Методы получения пористых материалов. Лекция 7
Адсорбция на пористых адсорбентах. Пористость. Методы получения пористых материалов. Лекция 7 Алкины. Ацетиленовые углеводороды
Алкины. Ацетиленовые углеводороды Минеральные вяжущие вещества
Минеральные вяжущие вещества Химические свойства основных оксидов
Химические свойства основных оксидов Торий. Алынуы
Торий. Алынуы Описание проведения опыта. Зажгите свечу
Описание проведения опыта. Зажгите свечу Сталь, железо и чугун
Сталь, железо и чугун Оксид углерода-С
Оксид углерода-С Твердое состояние вещества. Кристаллические и аморфные тела
Твердое состояние вещества. Кристаллические и аморфные тела Диагностика метаморфических и гидротермальных горных пород
Диагностика метаморфических и гидротермальных горных пород Химические свойства получение и применение солей
Химические свойства получение и применение солей Теория электрической диссоциации
Теория электрической диссоциации