Содержание
- 2. УЧЕБНАЯ ТЕМА: ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ СВОЙСТВА СЕРЫ НА ПРИМЕРЕ ТИОСУЛЬФАТА НАТРИЯ Цели учебного исследования: изучить окислительно-восстановительные свойства тиосульфата
- 3. МЕТОДИКА ЗАНЯТИЯ Приготовить 5% раствор тиосульфата натрия и провести реакции: С раствором соляной кислоты С раствором
- 4. ОТЧЕТ О РАБОТЕ Na2S2O3 + 2HCl = S+ SO2 + 2 NaCl + H2O S+2 +
- 6. С РАСТВОРОМ ЙОДА Na2S2O3+ I2 = Na2S4O6 + NaI 2S2O32--2e-=S4O62- |1 I20+2e-=2I- |1 2S2O32-+I20+=S4O62-+2I- Наблюдаем обесцвечивание
- 8. С ХЛОРНОЙ ВОДОЙ Na2S2O3 +4Cl2 +5H2O = 2NaCl + 6HCl + 2H2SO4 S2O32--8e - + 5H2O
- 10. С РАСТВОРОМ ХЛОРИДА ЖЕЛЕЗА (III) Наблюдаем появление интенсивной фиолетовой окраски, обусловленной образованием комплексного соединения железа –
- 13. С РАСТВОРОМ НИТРАТА СЕРЕБРА С серебра нитратом (в избытке AgNO3). Образуется белый осадок, быстро желтеет, ввиду
- 16. Скачать презентацию













 Введение в ЭТМ и основы строения и свойств материалов. (1)
Введение в ЭТМ и основы строения и свойств материалов. (1) Окислы и их свойства
Окислы и их свойства Лекарственные средства, производные пиридина и пиперазина
Лекарственные средства, производные пиридина и пиперазина Роль воды в химических реакциях
Роль воды в химических реакциях Сера и ее соединения
Сера и ее соединения Химия s-элементов. Общая характеристика
Химия s-элементов. Общая характеристика Спирти. Насичені одноатомні спирти: формули, ізомерія, систематична номенклатура
Спирти. Насичені одноатомні спирти: формули, ізомерія, систематична номенклатура Простые вещества - неметаллы. 8 класс
Простые вещества - неметаллы. 8 класс Предмет органической химии. Основные положения теории химического строения органических соединений
Предмет органической химии. Основные положения теории химического строения органических соединений Углеводы. Молекулярные формулы
Углеводы. Молекулярные формулы Химическая кинетика. Основные закономерности протекания химических реакций (лекция 5)
Химическая кинетика. Основные закономерности протекания химических реакций (лекция 5) Химические свойства воды
Химические свойства воды Реакції йонного обміну між електролітами у водних розчинах. Практична робота №1. 9 клас
Реакції йонного обміну між електролітами у водних розчинах. Практична робота №1. 9 клас Валентность и степень окисления
Валентность и степень окисления Арены. Бензол и его гомологи
Арены. Бензол и его гомологи Химическая промышленность
Химическая промышленность Современные проблемы молекулярной биологии
Современные проблемы молекулярной биологии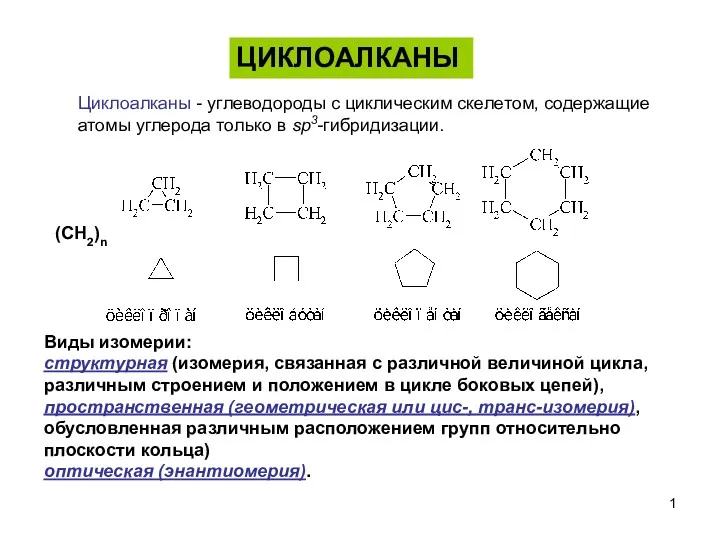 Циклоалканы
Циклоалканы Ионная химическая связь
Ионная химическая связь Применение водорода. Будущие водородные технологии. Урок химии в 8 классе
Применение водорода. Будущие водородные технологии. Урок химии в 8 классе Хозяйственный механизм НГХК
Хозяйственный механизм НГХК Химическая связь и ее типы. Основные классы неорганических соединений
Химическая связь и ее типы. Основные классы неорганических соединений Types of chemical reactions
Types of chemical reactions соединения VI группы продвинутая версия
соединения VI группы продвинутая версия Основные характеристики клеев
Основные характеристики клеев Задачи
Задачи Химический состав клетки
Химический состав клетки Аллотропия
Аллотропия