Содержание
- 2. Общая характеристика s - элементов IА-группа: Li, Na, K, Rb, Cs, Fr щелочные металлы IIA-группа: Be,
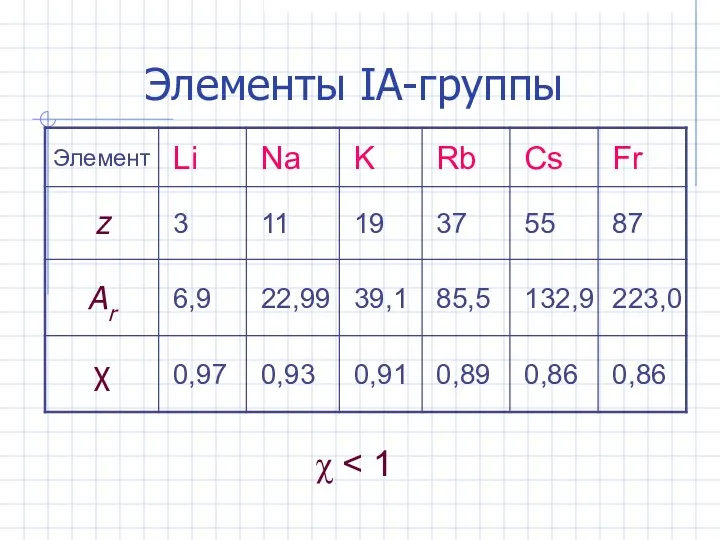
- 3. Элементы IА-группы
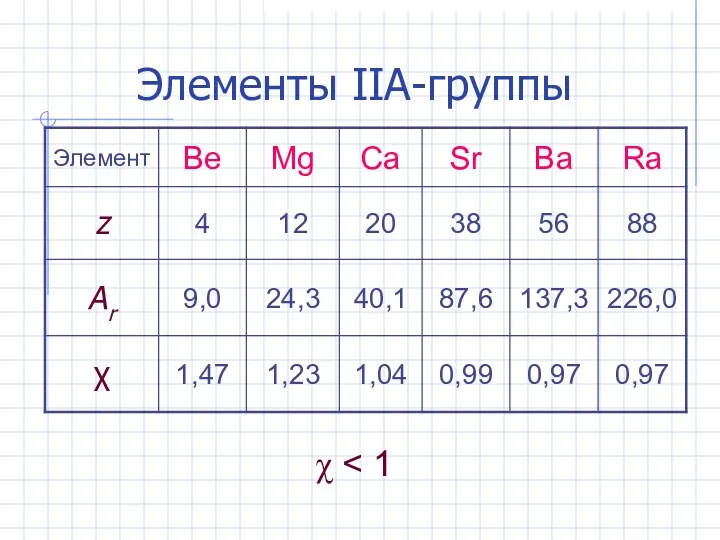
- 4. Элементы IIА-группы
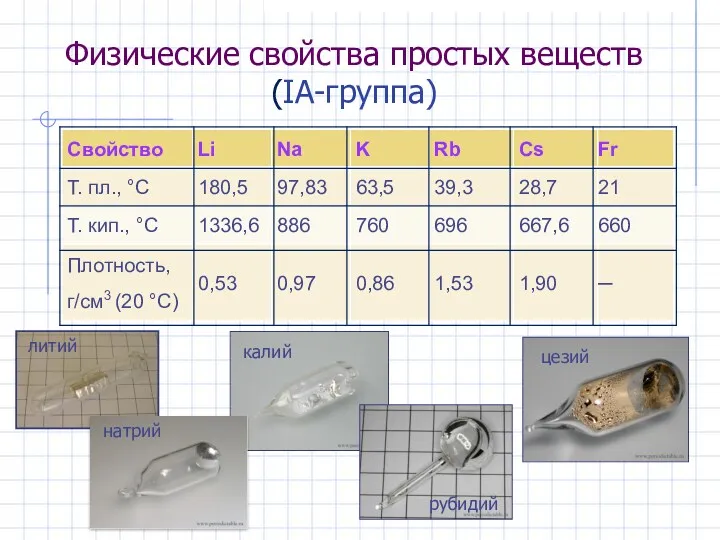
- 5. Физические свойства простых веществ (IА-группа)
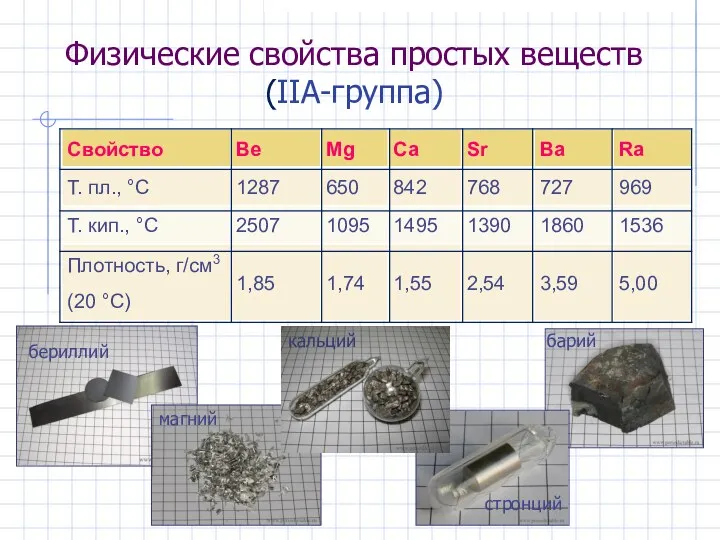
- 6. Физические свойства простых веществ (IIА-группа)
- 7. Общая характеристика s -элементов. Простые вещества Простые вещества : все – активные металлы (кроме Be) Реагируют
- 8. Общая характеристика s – элементов. Взаимодействие металлов с водой и кислотами 2Na + 2H2O = 2NaOH
- 9. Общая характеристика s – элементов. Сложные вещества: оксиды , гидроксиды Mn+ – катионы в ионных кристаллах
- 10. Общая характеристика s – элементов. Сложные вещества: соли Соли: аквакатионы – непротолиты (кроме солей Be и
- 11. Общая характеристика s – элементов. Сложные вещества Бинарные соединения: гидриды MH, MH2; пероксиды M2O2, MO2; нитриды
- 12. Распространение в природе 5. Ca – 3,38 % 6. Na – 2,63 % 7. K –
- 13. Важнейшие минералы IА-группа Галит (каменная соль) NaCl Карналлит KMgCl3.6H2O Мирабилит Na2SO4·10H2O Поллуцит (Cs,Na)Al(SiO3)2.nH2O Сильвин KCl Сильвинит
- 14. Важнейшие минералы Фенакит Be2SiO4 Берилл (Be3Al2)Si6O18 (аквамарин, изумруд). Гипс CaSO4·2H2O Кальцит CaCO3 (известняк, мрамор, мел) Магнезит
- 16. Скачать презентацию









 Углерод. Элемент IV группы
Углерод. Элемент IV группы Электронный помощник по химии 8 класс
Электронный помощник по химии 8 класс Химия переходных элементов IV – V группы
Химия переходных элементов IV – V группы Общая характеристика неметаллов
Общая характеристика неметаллов Ископаемые углеводороды
Ископаемые углеводороды Закон сохранения массы веществ. Химические уравнения
Закон сохранения массы веществ. Химические уравнения Гидролиз солей
Гидролиз солей Неорганическая химия
Неорганическая химия Химический анализ веществ
Химический анализ веществ Альдегиды и кетоны
Альдегиды и кетоны Углеводы. 10 класс
Углеводы. 10 класс Углеводороды. Применение природных источников углеводородов и продуктов их переработки
Углеводороды. Применение природных источников углеводородов и продуктов их переработки Состав, строение и свойства натурального каучука
Состав, строение и свойства натурального каучука Титан және титан қорытпалары. Деформацияланған және кұйма титан қорытпалары
Титан және титан қорытпалары. Деформацияланған және кұйма титан қорытпалары Химическая технология природных энергоносителей и углеродных материалов
Химическая технология природных энергоносителей и углеродных материалов Кислые породы умеренно-щелочного ряда
Кислые породы умеренно-щелочного ряда Классификация химических реакций
Классификация химических реакций Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений. Амфотерные оксиды и гидроксиды
Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений. Амфотерные оксиды и гидроксиды Первые шаги в минералогию: от новичка до знатока
Первые шаги в минералогию: от новичка до знатока Инертные газы
Инертные газы Металлогеническая периодизация истории Земли. Геолого-металлогенические ранги
Металлогеническая периодизация истории Земли. Геолого-металлогенические ранги Диссоциация кислот, оснований, солей
Диссоциация кислот, оснований, солей 20231110_zakon_avogadro
20231110_zakon_avogadro Спирттер мен фенолдар
Спирттер мен фенолдар Аминокислоты и белки
Аминокислоты и белки Карбон
Карбон Класифікація дисперсних систем харчових продуктів. Характеристика колоїдних систем
Класифікація дисперсних систем харчових продуктів. Характеристика колоїдних систем Азотная кислота
Азотная кислота