Содержание
- 2. Нахождение в природе Алмаз, графит СО2 Каменный и бурый угли, торф Нефть Природный газ (СН4) Карбонаты
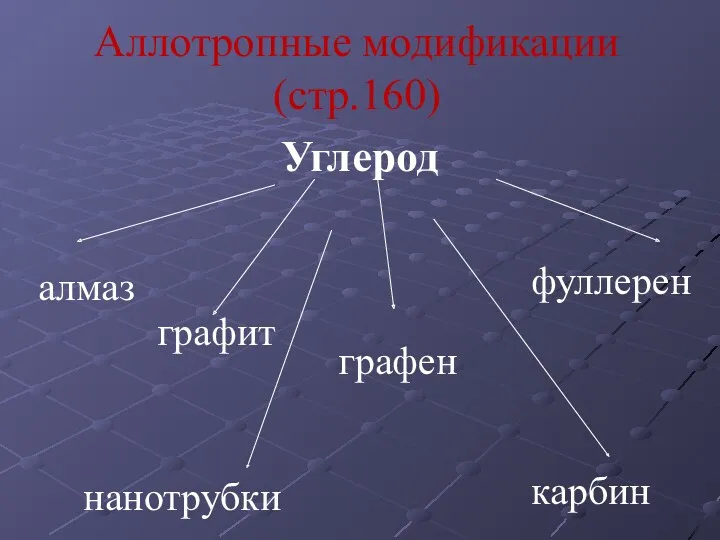
- 3. Аллотропные модификации (стр.160) Углерод алмаз графит фуллерен графен карбин нанотрубки
- 4. Алмаз
- 5. Графит 100 тыс. атм., 2600оС, катализатор Графит Алмаз
- 6. Применение алмаза и графита Алмаз 1. Ювелирные изделия 2. Резцы, сверла 3. Буры Графит 1. Электроды
- 7. Карбин
- 8. Фуллерен
- 9. В 1991г совершенно неожиданно были обнаружены длинные цилиндрические каркасные структуры, получившие название нанотрубок. Открыл их японский
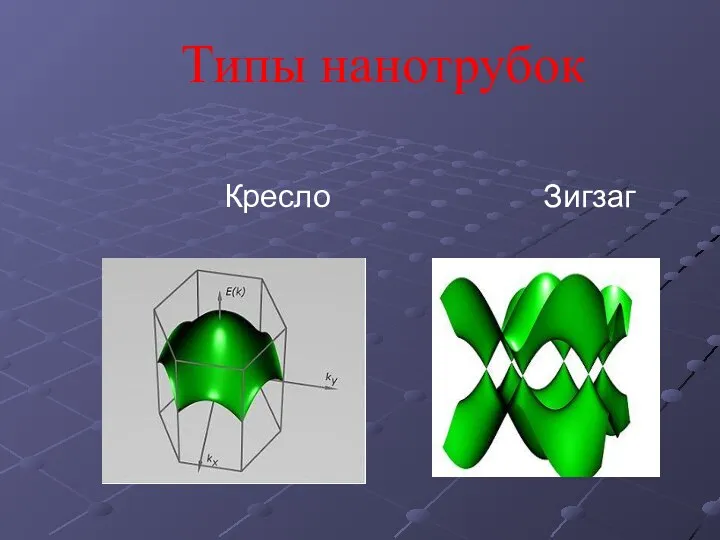
- 10. Типы нанотрубок Кресло Зигзаг
- 11. Сотни тысяч научных публикаций подтвердили, что одностенные углеродные нанотрубки: - в 100 раз прочнее стали; -
- 12. Графен Графеновые транзисторы, закрепленные на кусочке прозрачного пластика. Графен не только самый прочный материал в мире,
- 13. Лонсдейлит Является одним из самых твёрдых из известных веществ, на 58 % превосходящем по жёсткости алмаз
- 14. Адсорбция Адсорбция (лат. ad — на, при; sorbeo — поглощаю) — поглощение газов и растворенных веществ
- 15. Алмаз, графит, карбин, фуллерен – кристаллические структуры Сажа, уголь – мелкокристаллический графит (аморфный углерод)
- 16. Электронная формула , степени окисления 1S22S22p2 - 4, 0, +2, +4
- 17. Химические свойства углерода восстановитель ( +2, +4) С + О2 → ….. С + S →
- 19. Скачать презентацию














 Химическое равновесие. Принцип Ле Шателье
Химическое равновесие. Принцип Ле Шателье Соединения галогенов
Соединения галогенов Аминокислоты. Пептиды. Хроматографические методы исследования
Аминокислоты. Пептиды. Хроматографические методы исследования Химическая связь
Химическая связь Массовая доля вещества в растворе
Массовая доля вещества в растворе Визначення іонів лужних і лужноземельних іонів у природних водах
Визначення іонів лужних і лужноземельних іонів у природних водах Уникальная соль (для дошколников)
Уникальная соль (для дошколников) Пищевые добавки
Пищевые добавки Коллигативные свойства растворов
Коллигативные свойства растворов Основы термической и химико-термической обработки стали. Теория и технология термической обработки стали. Лекция 3. Тема 7
Основы термической и химико-термической обработки стали. Теория и технология термической обработки стали. Лекция 3. Тема 7 Литий. Физические свойства лития
Литий. Физические свойства лития Типы заданий. ЕГЭ №32
Типы заданий. ЕГЭ №32 20230419_izomery
20230419_izomery Растворы и растворители
Растворы и растворители Фосфор и его соединения
Фосфор и его соединения Общая характеристика неметаллов
Общая характеристика неметаллов Простые вещества. Игра Счастливый случай
Простые вещества. Игра Счастливый случай Элемент, имеющий относительную атомную массу
Элемент, имеющий относительную атомную массу Введение в аналитическую химию. Введение в качественный анализ
Введение в аналитическую химию. Введение в качественный анализ Алканы. Гомологи
Алканы. Гомологи Методы разделения и исследования состава нефти и газа
Методы разделения и исследования состава нефти и газа Формальная кинетика. Предмет химической кинетики
Формальная кинетика. Предмет химической кинетики Хром. Элемент под № 24
Хром. Элемент под № 24 Аммиак. Состав вещества
Аммиак. Состав вещества Галогены. Фтор, хлор, бром, йод, астат
Галогены. Фтор, хлор, бром, йод, астат Породообразующие минералы
Породообразующие минералы Особенности строения, реакционной способности и методы синтеза гидроксилсодержащих соединений
Особенности строения, реакционной способности и методы синтеза гидроксилсодержащих соединений Взрывоопасные грузы
Взрывоопасные грузы