Содержание
- 2. Экспресс опрос класса: 1. Какие элементы называются галогенами? 2. Охарактеризуйте положение галогенов в Периодической системе Д.И.Менделеева.
- 3. Галогеноводороды: HF - фтороводородная кислота ( плавиковая) HCl - хлороводородная кислота (соляная) HBr - бромоводородная кислота
- 4. Почему сила кислоты HI>HF ? F +53 I +9 2 7 2 8 18 18 7
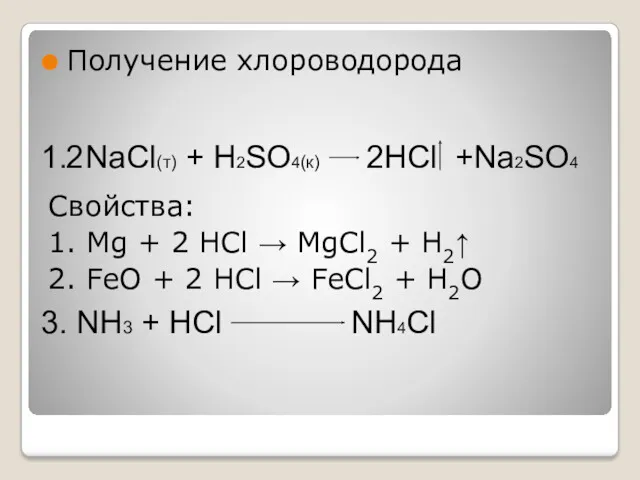
- 5. Получение хлороводорода Свойства: 1. Mg + 2 HCl → MgCl2 + H2↑ 2. FeO + 2
- 6. Взаимодействие плавиковой кислоты и стекла: SiO2+ 4HF (газ) = SiF4+ 2H2O
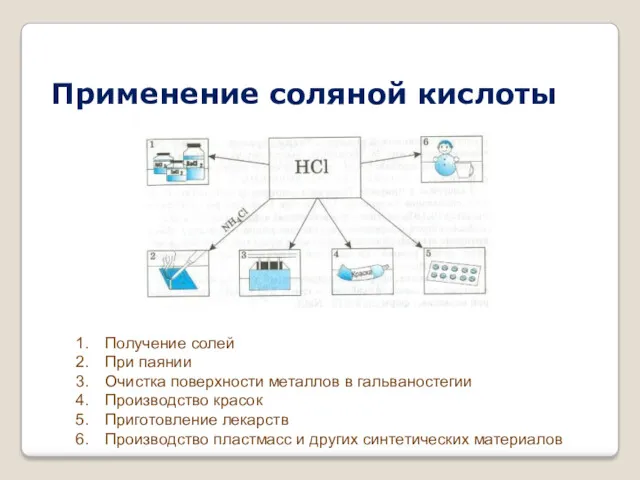
- 7. Применение соляной кислоты Получение солей При паянии Очистка поверхности металлов в гальваностегии Производство красок Приготовление лекарств
- 8. Соли: F фториды CL хлориды хлорид натрия(галит) Br бромиды бромид серебра J йодиды йодид калия фторид
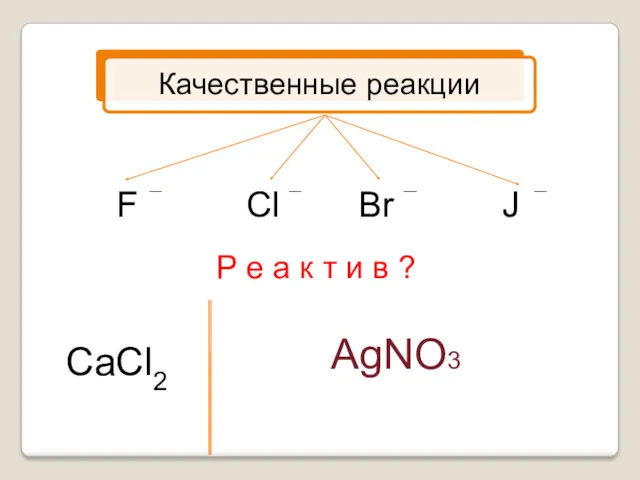
- 9. F Cl Br J Р е а к т и в ? CaCl2 AgNO3
- 10. Качественные реакции NaCl + AgNO3 = NaBr + AgNO3 = NaJ + AgNO3 = AgCl +
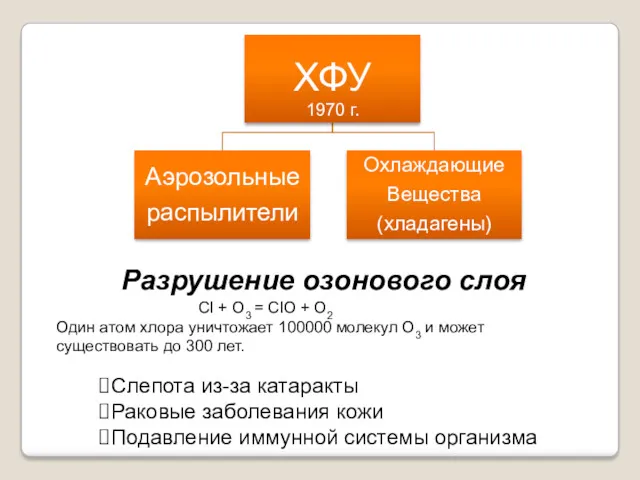
- 11. Разрушение озонового слоя Слепота из-за катаракты Раковые заболевания кожи Подавление иммунной системы организма CI + O3
- 13. Скачать презентацию






 Органикалық қосылыстар
Органикалық қосылыстар Діагностика за показами газоаналізатора. Типи газоаналізаторів
Діагностика за показами газоаналізатора. Типи газоаналізаторів Класифікація дисперсних систем харчових продуктів. Характеристика колоїдних систем
Класифікація дисперсних систем харчових продуктів. Характеристика колоїдних систем Дисперсные системы. Дисперсное состояние вещества. Лекция 10
Дисперсные системы. Дисперсное состояние вещества. Лекция 10 Теория электролитической диссоциации
Теория электролитической диссоциации Производные фенантренизохинолина
Производные фенантренизохинолина Вчення про розчини. Рівновага в розчинах електролітів
Вчення про розчини. Рівновага в розчинах електролітів Паровые зоны в гидротермальных системах
Паровые зоны в гидротермальных системах Химические свойства легкоплавких металлов
Химические свойства легкоплавких металлов Сильные и слабые электролиты. Равновесие в растворах слабых электролитов. (Лекция 8)
Сильные и слабые электролиты. Равновесие в растворах слабых электролитов. (Лекция 8) Алюминий и его соединения
Алюминий и его соединения Обчислення за хімічними рівняннями відносного виходу продукту реакції. Урок №19. 11 клас
Обчислення за хімічними рівняннями відносного виходу продукту реакції. Урок №19. 11 клас Непредельные углеводороды. Алкены
Непредельные углеводороды. Алкены Металдарға жалпы сипаттама
Металдарға жалпы сипаттама Пируватдегидрогеназный комплекс
Пируватдегидрогеназный комплекс Углерод. Carbon
Углерод. Carbon Газы, применяемые при сварке
Газы, применяемые при сварке Коррозия и защита строительных материалов
Коррозия и защита строительных материалов Ароматические соединения. Тема № 5
Ароматические соединения. Тема № 5 Алюминий
Алюминий Обобщающий урок по теме Металлы
Обобщающий урок по теме Металлы Своя игра по химии
Своя игра по химии Теория электролитической диссоциации (ТЭД)
Теория электролитической диссоциации (ТЭД) Нафта. Класифікація нафти
Нафта. Класифікація нафти Химическая связь
Химическая связь Карбоновые кислоты
Карбоновые кислоты Основные химические понятия и законы
Основные химические понятия и законы Теория электролитической диссоциации
Теория электролитической диссоциации