Содержание
- 2. ХИМИЧЕСКАЯ СВЯЗЬ «Под химической связью следует понимать силу, удерживающую атомы друг около друга в молекулах, ионах
- 3. ПОЧЕМУ ОБРАЗУЕТСЯ ХИМИЧЕСКАЯ СВЯЗЬ? Ответ вытекает из следующего термодина-мического принципа: «минимуму энергии системы соответствует максимум устойчивости»
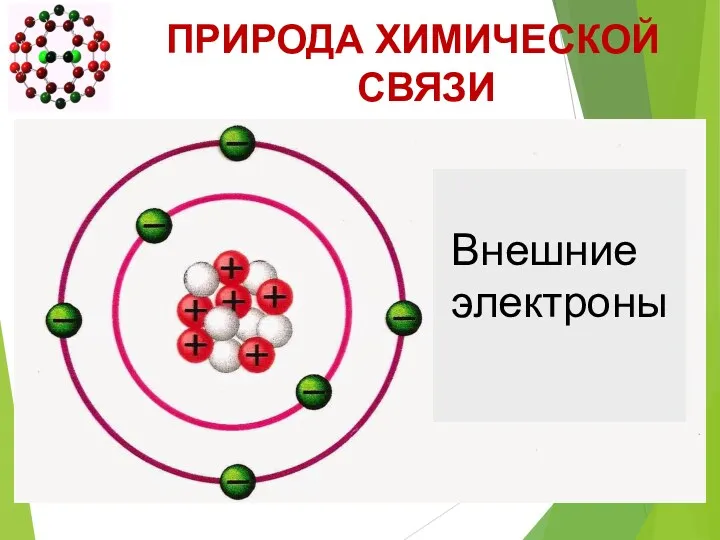
- 4. ПРИРОДА ХИМИЧЕСКОЙ СВЯЗИ
- 5. ПРАВИЛО ОКТЕТА (Льюис, 1875-1946) При образовании химической связи атомы стремятся приобрести устойчивую восьмиэлектронную (или двухэлектронную) внешнюю
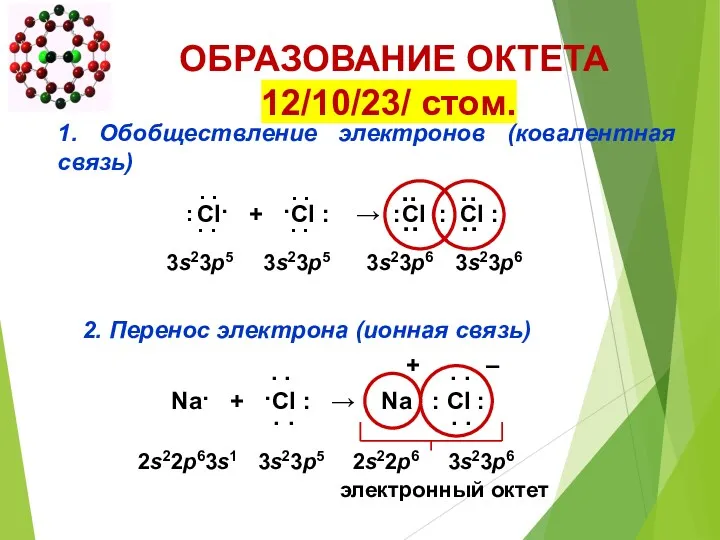
- 6. ОБРАЗОВАНИЕ ОКТЕТА 12/10/23/ стом. Cl· + ·Cl ׃ → ׃Cl ׃ Cl ׃ . . .
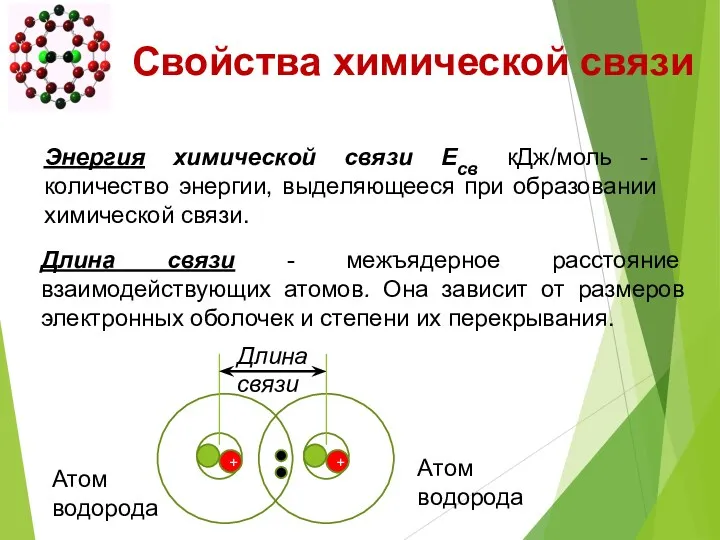
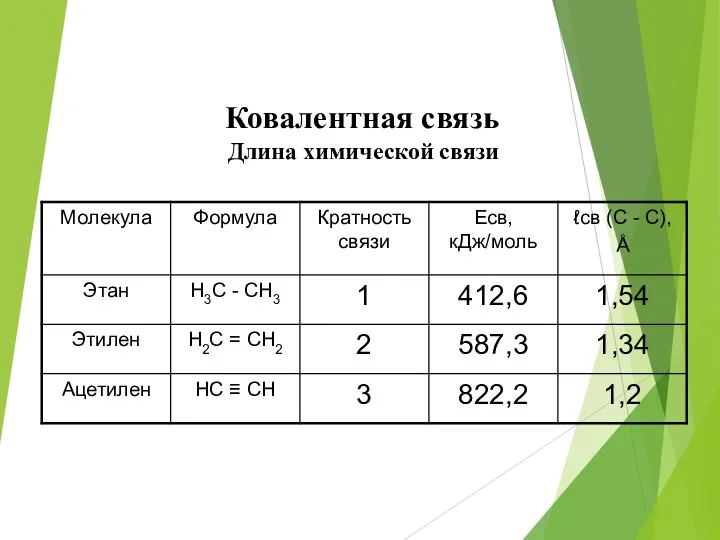
- 7. Свойства химической связи Длина связи - межъядерное расстояние взаимодействующих атомов. Она зависит от размеров электронных оболочек
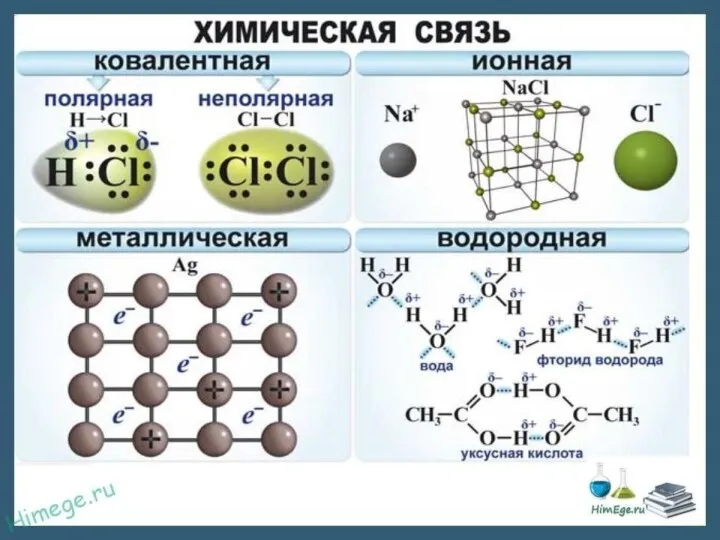
- 8. ТИПЫ ХИМИЧЕСКОЙ СВЯЗИ Ковалентная (полярная и неполярная) Ионная Металлическая. ОСНОВНЫЕ ТИПЫ: 1. Водородная химическая связь. 2.
- 11. Ионная связь В 1916 выдвинул гипотезу, которая легла в основу теории ионной химической связи и гетеровалентности
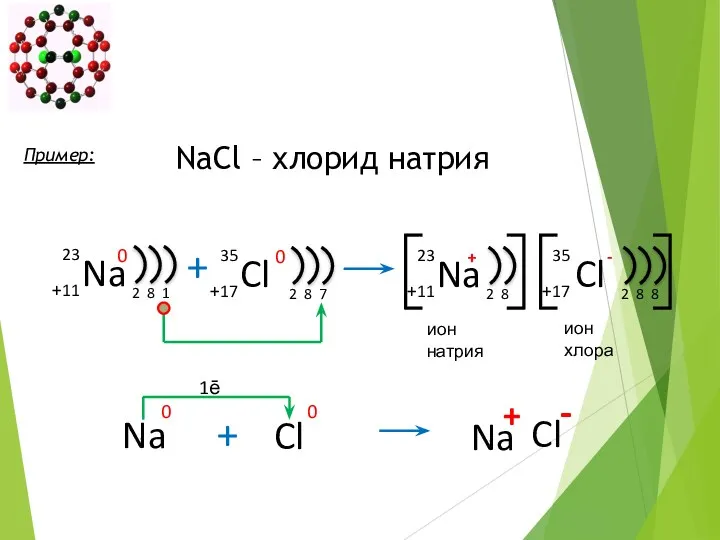
- 12. Ионная химическая связь -электростатическое взаимодействие отрицательно и положительно заряженных ионов в химическом соединении. ИОННАЯ СВЯЗЬ NaCl
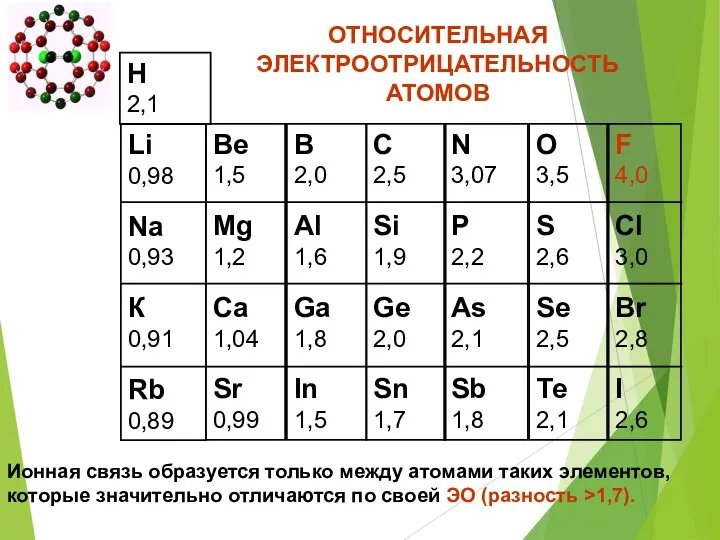
- 13. Li 0,98 Na 0,93 К 0,91 Rb 0,89 Be 1,5 Mg 1,2 Ca 1,04 Sr 0,99
- 15. Ионная химическая связь. 1ē
- 16. Ионная связь Ионная связь — сильная химическая связь, возникающая в результате электростатического притяжения катионов и анионов.
- 17. Примеры соединений с ионым типом связи CsF, КI, LiCl К2S, Nа2S Nа3N, Mg3N2 Nа2O, Li2O
- 18. Ковалентная связь Метод валентных связей (метод ВС) Гилберт Ньютон Льюис (англ. Gilbert Newton Lewis) (23 октября
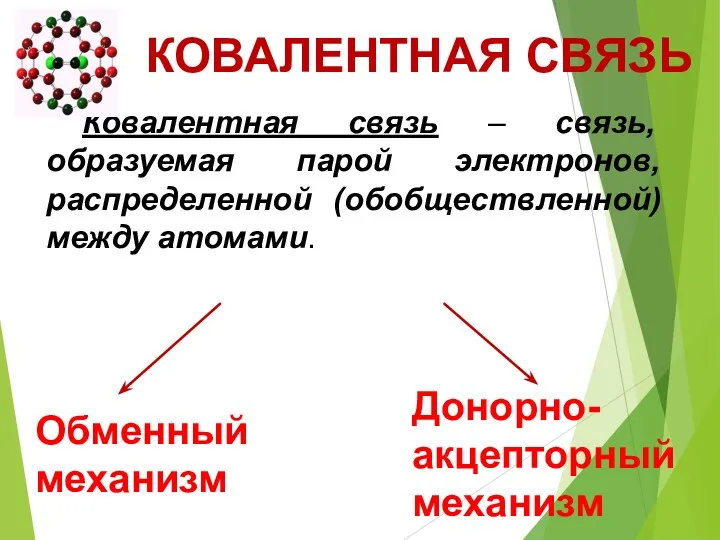
- 19. Ковалентная связь – связь, образуемая парой электронов, распределенной (обобществленной) между атомами. КОВАЛЕНТНАЯ СВЯЗЬ Обменный механизм Донорно-акцепторный
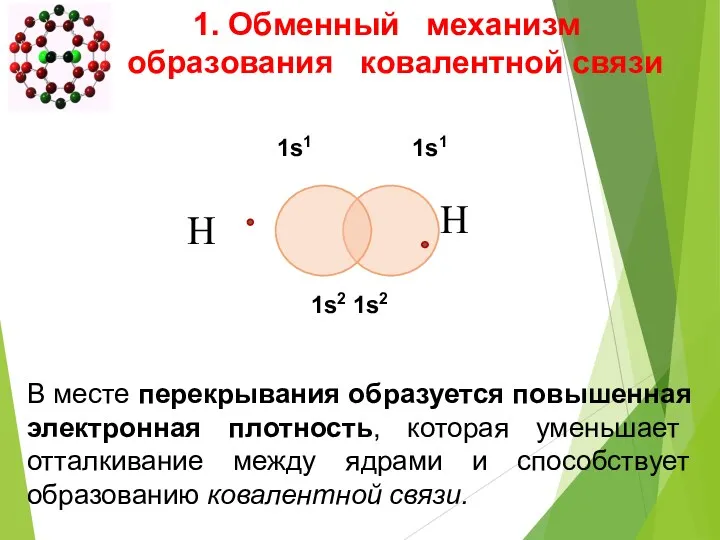
- 20. 1. Обменный механизм образования ковалентной связи 1s1 1s1 В месте перекрывания образуется повышенная электронная плотность, которая
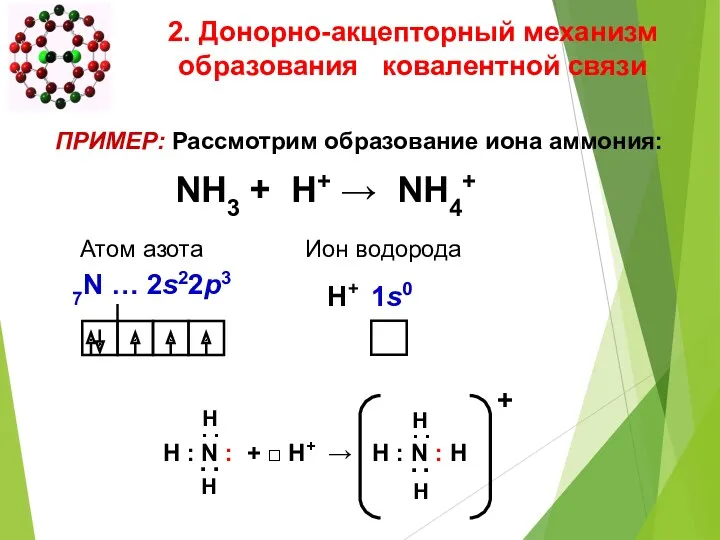
- 21. ПРИМЕР: Рассмотрим образование иона аммония: NH3 + H+ → NH4+ H ׃ N ׃ + □
- 22. Если электронная плотность расположена симметрично между атомами, ковалентная связь называется неполярной. Если электронная плотность смещена в
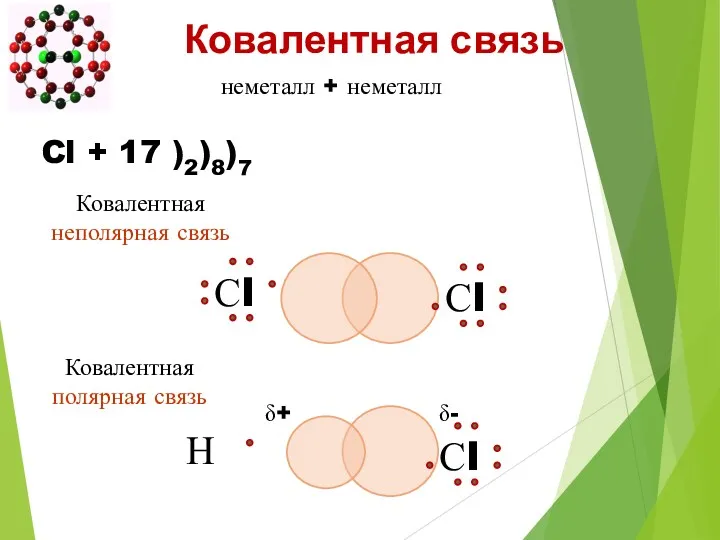
- 23. неметалл + неметалл Cl + 17 )2)8)7 Ковалентная связь δ+ δ- Ковалентная полярная связь Ковалентная неполярная
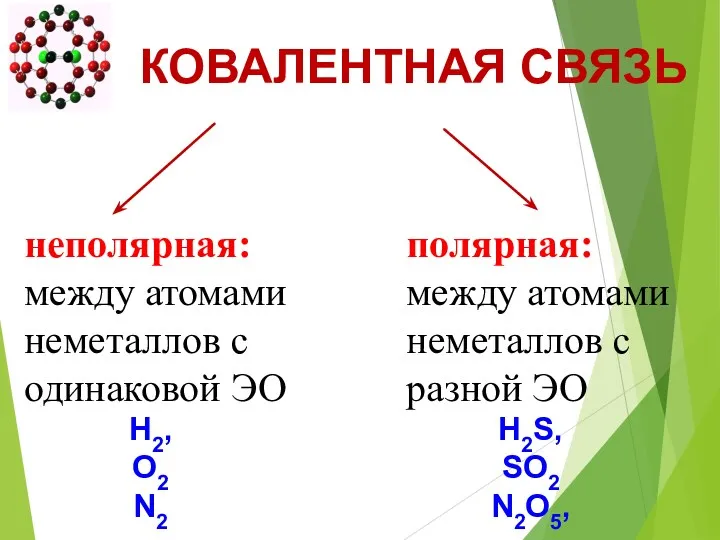
- 24. КОВАЛЕНТНАЯ СВЯЗЬ неполярная: между атомами неметаллов с одинаковой ЭО полярная: между атомами неметаллов с разной ЭО
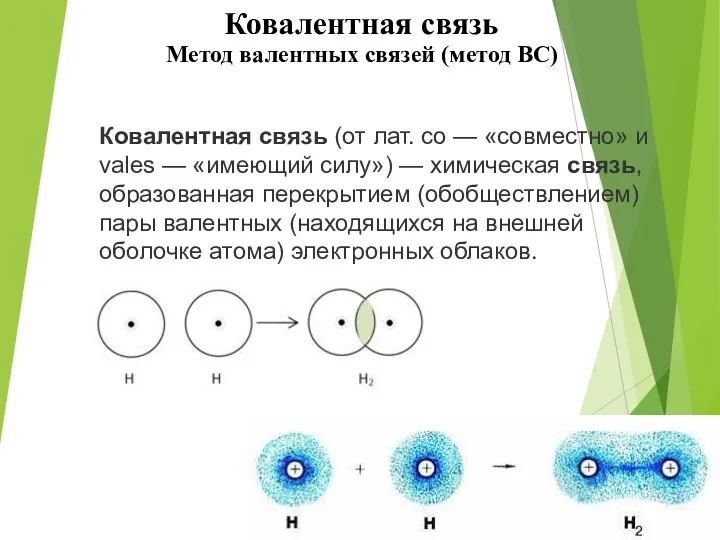
- 26. Ковалентная связь Метод валентных связей (метод ВС) Ковалентная связь (от лат. co — «совместно» и vales
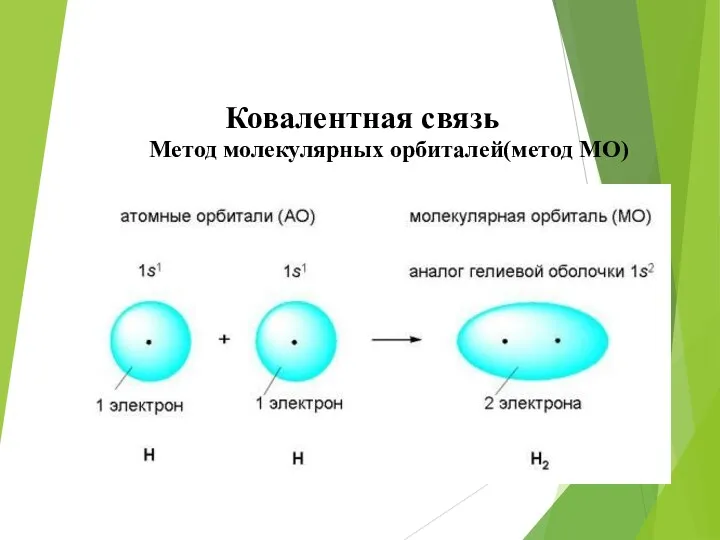
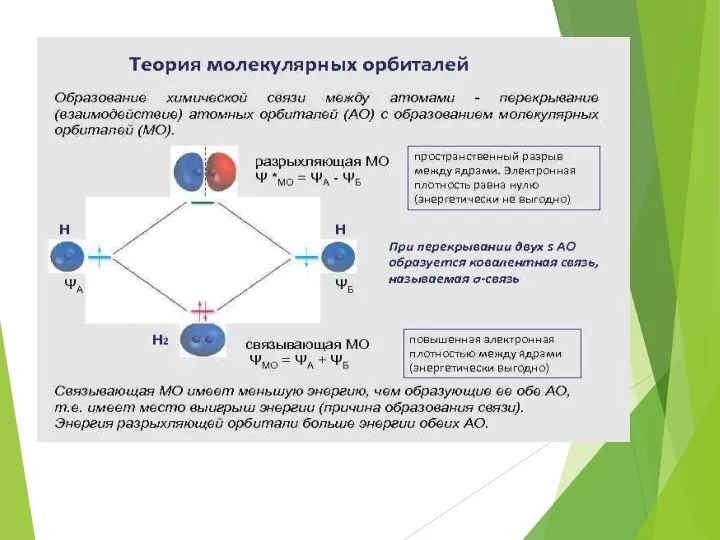
- 32. Ковалентная связь Метод молекулярных орбиталей(метод МО)
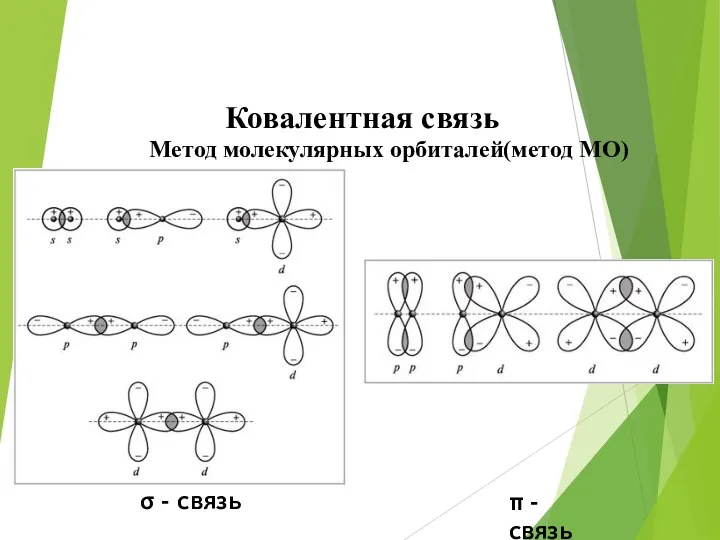
- 33. σ - связь π - связь Ковалентная связь Метод молекулярных орбиталей(метод МО)
- 36. Ковалентная связь Длина химической связи
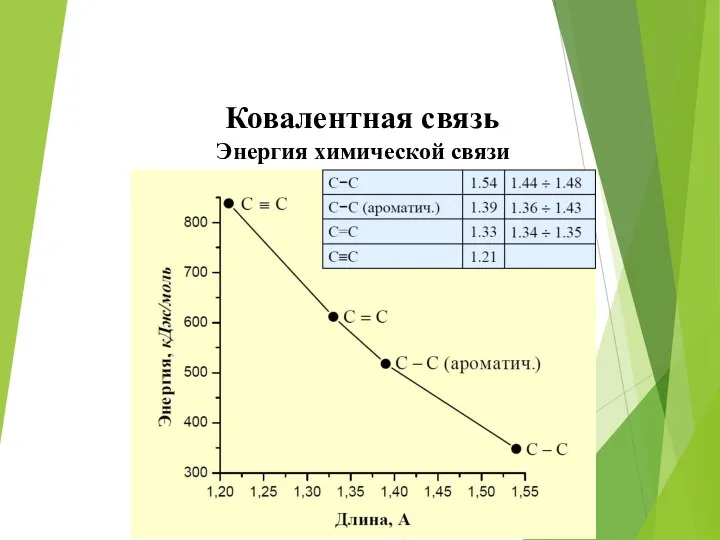
- 37. Ковалентная связь Энергия химической связи
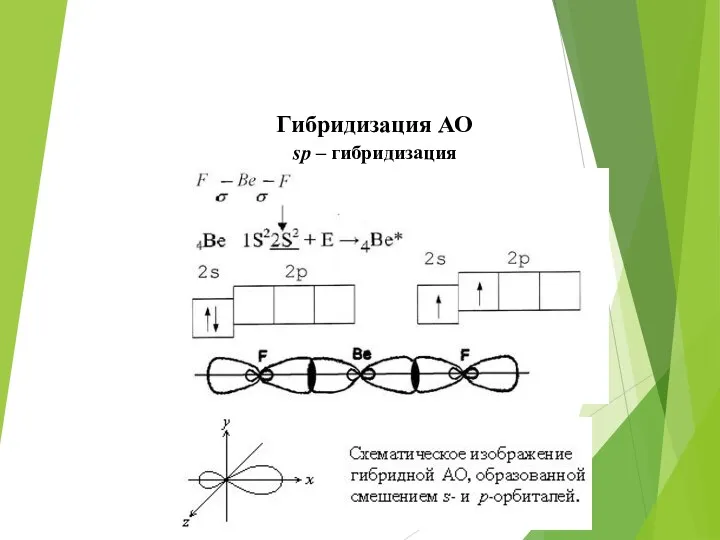
- 38. Гибридизация АО sp – гибридизация
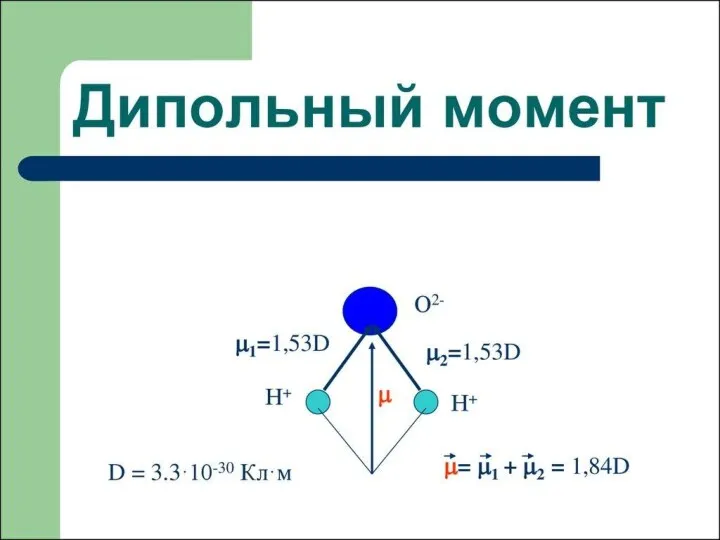
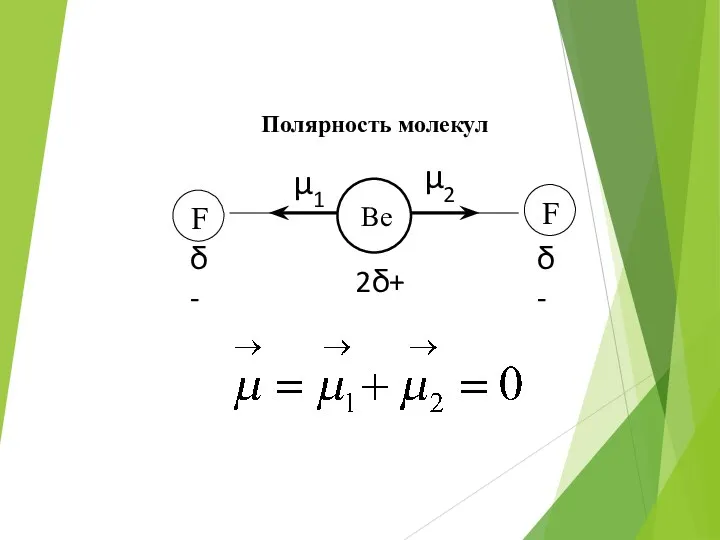
- 42. Полярность молекул
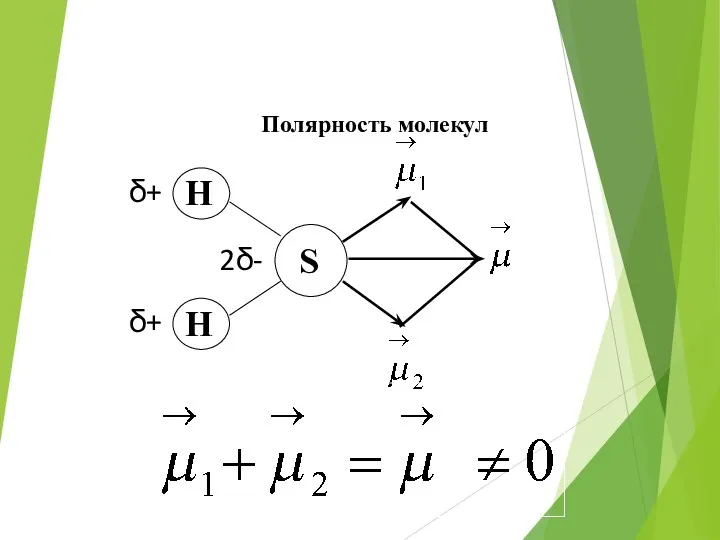
- 43. Полярность молекул
- 44. Полярность молекул
- 45. Металлическая связь
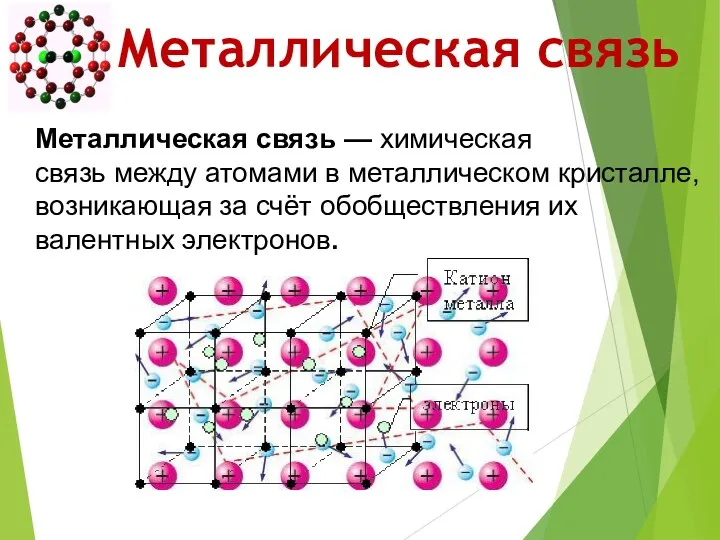
- 46. Металлическая связь Металлическая связь — химическая связь между атомами в металлическом кристалле, возникающая за счёт обобществления
- 47. Металлическая связь Металлическая кристаллическая решетка и металлическая связь определяют такие свойства металлов: ковкость, пластичность, электро- и
- 48. Водородная связь
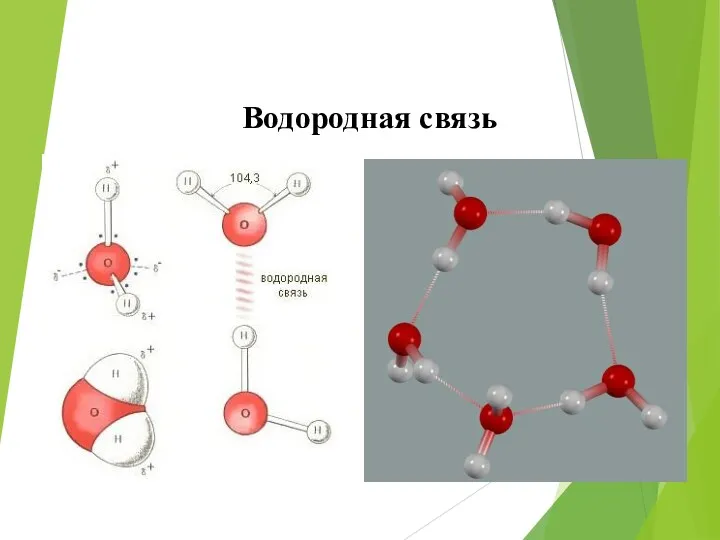
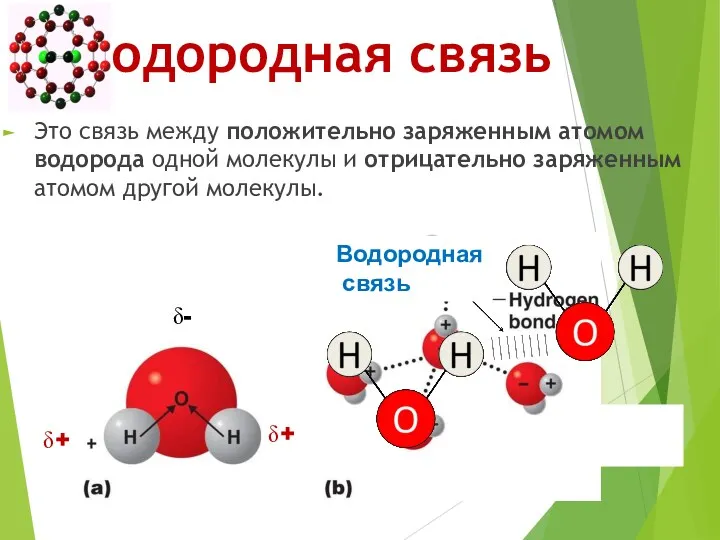
- 49. Водородная связь Это связь между положительно заряженным атомом водорода одной молекулы и отрицательно заряженным атомом другой
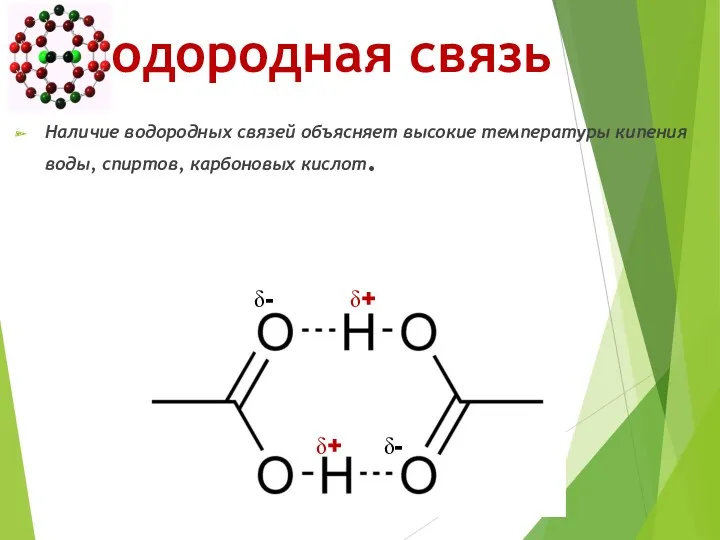
- 50. Водородная связь Наличие водородных связей объясняет высокие температуры кипения воды, спиртов, карбоновых кислот. δ+ δ- δ-
- 51. Механизм образования водородной связи Электростатическое притяжение атома водорода, имеющего частично положительный заряд, и атома кислорода (фтора
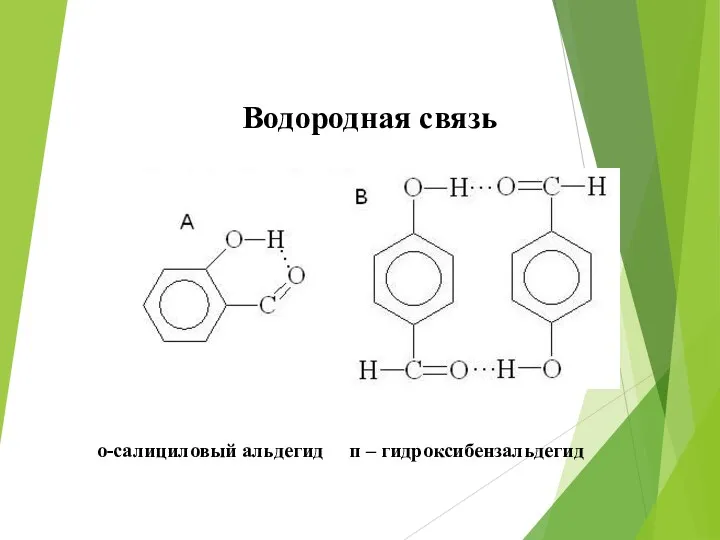
- 52. Водородная связь о-салициловый альдегид п – гидроксибензальдегид
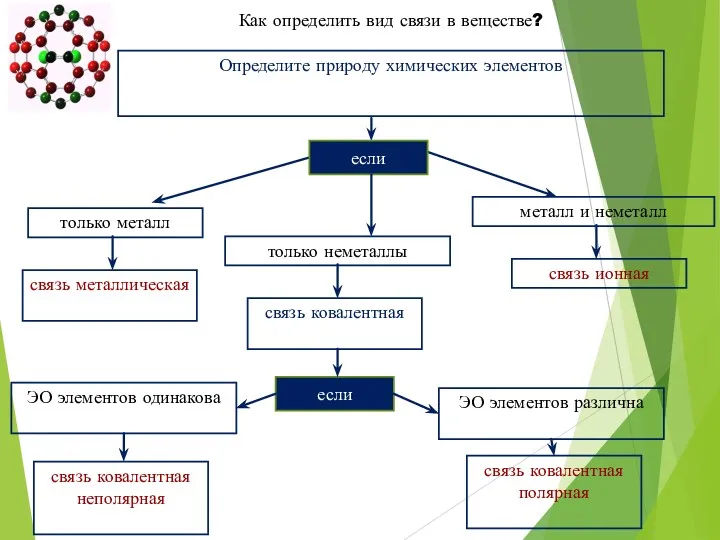
- 53. Как определить вид связи в веществе? Определите природу химических элементов если только металл только неметаллы металл
- 55. Силы Ван-дер- Ваальса Ян Дидерик Ван-дер-Ваа́льс (23 ноября 1837 — 8 марта 1923) Диполь-дипольное взаимодействие: Индукционное
- 57. Скачать презентацию


























 Полімери. Будова і властивості полімерів
Полімери. Будова і властивості полімерів Индикаторы кислотно-основного титрования
Индикаторы кислотно-основного титрования Высокомолекулярные соединения полимеры
Высокомолекулярные соединения полимеры Композиты как материалы конструкционного назначения
Композиты как материалы конструкционного назначения Синтетические моющие средства
Синтетические моющие средства Получение и химические свойства оснований
Получение и химические свойства оснований Металлы в природе. Общие способы их получения
Металлы в природе. Общие способы их получения Электронно-ионный баланс и Закон Авогадро. 8 класс
Электронно-ионный баланс и Закон Авогадро. 8 класс Классификация органических соединений. Урок химии в 10 классе
Классификация органических соединений. Урок химии в 10 классе Материаловедение и методы диагностики микро- и наноструктурных материалов
Материаловедение и методы диагностики микро- и наноструктурных материалов Соли. Классификация. Физические и химические свойства. Получение и применение солей
Соли. Классификация. Физические и химические свойства. Получение и применение солей Alkynes
Alkynes Воздух и его состав. Урок химии. 8 класс
Воздух и его состав. Урок химии. 8 класс Пластмаси. Пластичні маси
Пластмаси. Пластичні маси Спирты. Лекция
Спирты. Лекция Генетическая связь между классами неорганических соединений. Урок 1
Генетическая связь между классами неорганических соединений. Урок 1 Введение. Методы и средства обучения химии
Введение. Методы и средства обучения химии Проект узла регенерации растворителя уксусной кислоты производства терефталевой кислоты
Проект узла регенерации растворителя уксусной кислоты производства терефталевой кислоты Промежуточные фазы в металлических сплавах
Промежуточные фазы в металлических сплавах Изомерия
Изомерия Созвездие талантов. Игра-зачет по теме Основные классы неорганической химии 8 класс
Созвездие талантов. Игра-зачет по теме Основные классы неорганической химии 8 класс Сульфидтер. Аз еруші сульфидтер
Сульфидтер. Аз еруші сульфидтер Галогены. Химические свойства. Применение
Галогены. Химические свойства. Применение Кислоты. Яблочная кислота
Кислоты. Яблочная кислота Теоретические основы биоорганической химии
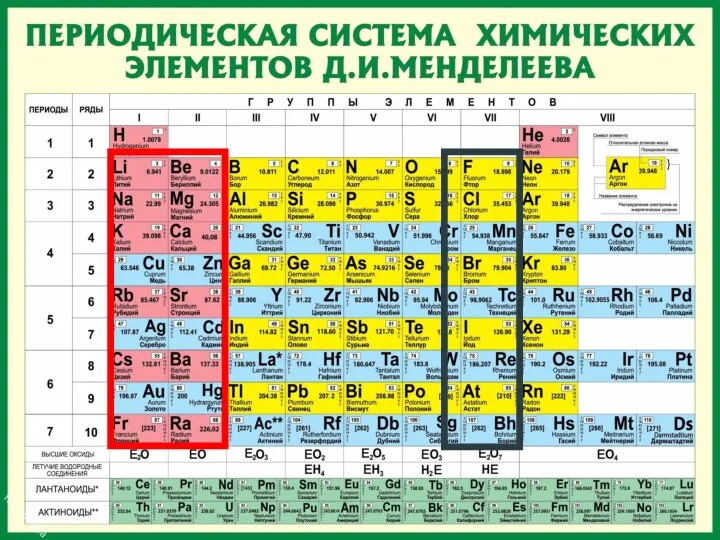
Теоретические основы биоорганической химии Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Контроль качества лекарственных средств производных спиртов и альдегидов
Контроль качества лекарственных средств производных спиртов и альдегидов Розрахункові задачі. Обчислення за хімічними рівняннями. Відносного виходу продукту реакції
Розрахункові задачі. Обчислення за хімічними рівняннями. Відносного виходу продукту реакції