Содержание
- 2. Соли. Классификация. Физические и химические свойства. Получение и применение солей.
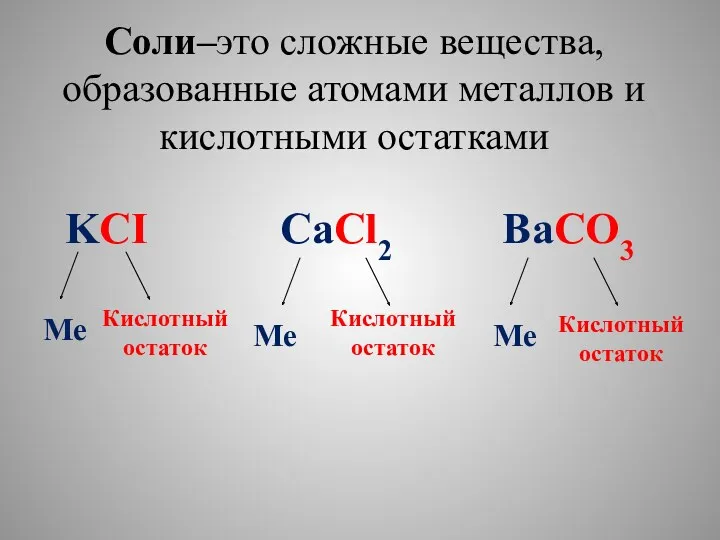
- 3. Соли–это сложные вещества, образованные атомами металлов и кислотными остатками KCI CaCl2 BaCO3 Ме Ме Ме Кислотный
- 4. Номенклатура солей Название Название Указание Кислотного + металла (в Р.п.) + валентности остатка (если она переменная)
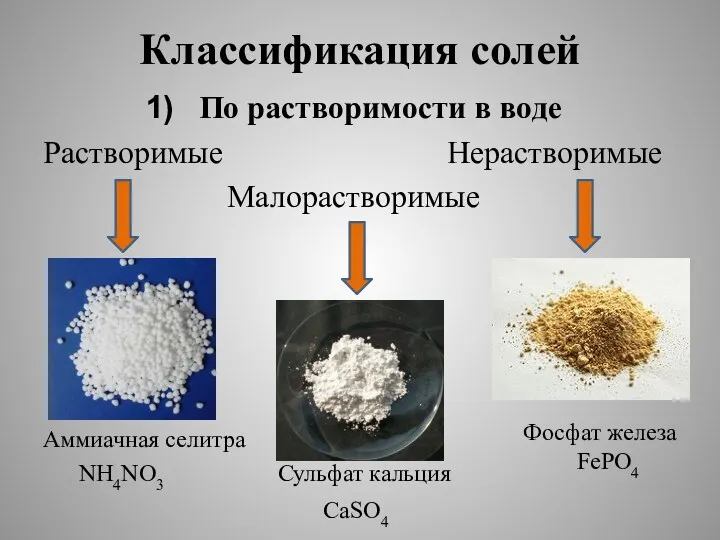
- 5. Классификация солей По растворимости в воде Растворимые Нерастворимые Малорастворимые Аммиачная селитра NH4NO3 Сульфат кальция Фосфат железа
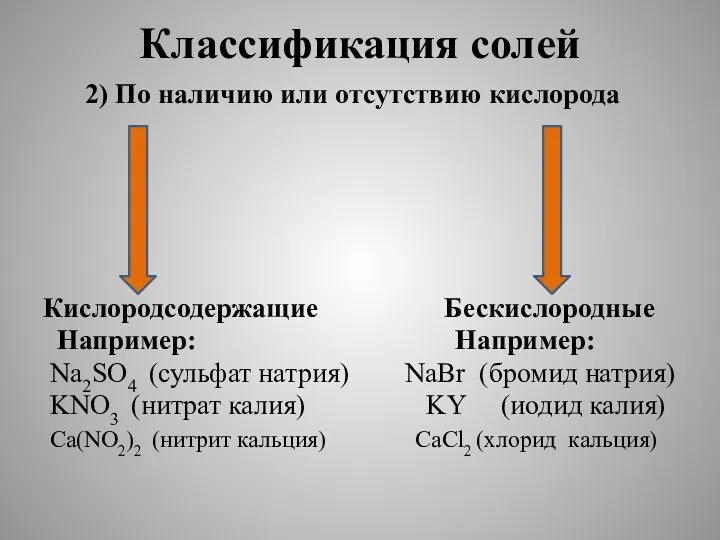
- 6. Классификация солей 2) По наличию или отсутствию кислорода Кислородсодержащие Бескислородные Например: Например: Na2SO4 (сульфат натрия) NaBr
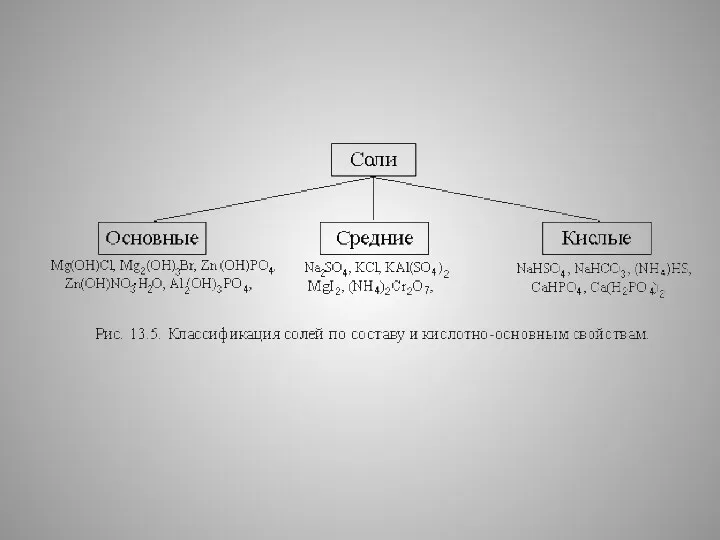
- 8. Разновидности солей Соли бывают: Средние соли – это продукты полного замещения атомов водорода в кислоте на
- 9. Разновидности солей 2) Кислые соли – это продукты неполного замещения атомов водорода в кислоте на металл.
- 10. Разновидности солей 3) Основные соли – это продукты неполного замещения гидроксогрупп в основании на кислотный остаток.
- 11. Химические свойства Соль + кислота = другая соль + другая кислота H2SO4 + BaCl2 = BaSO4
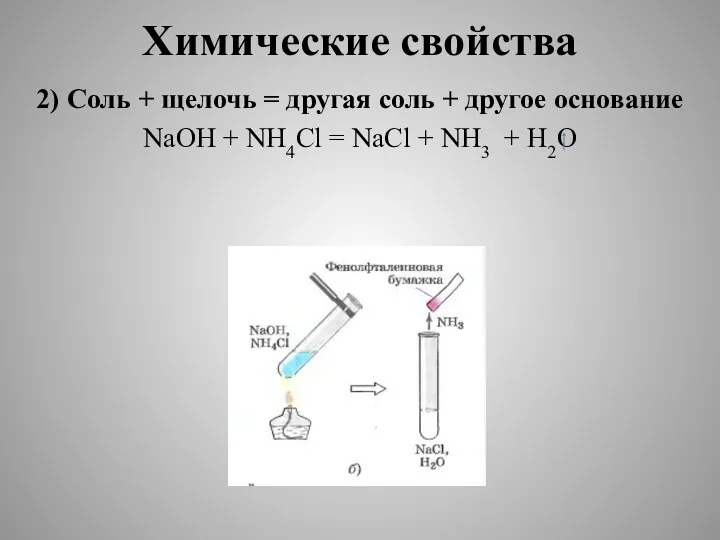
- 12. Химические свойства 2) Соль + щелочь = другая соль + другое основание NaOH + NH4Cl =
- 13. Химические свойства 3) Соль1 + соль2 = соль3 + соль4 Na2SO4 + BaCl2 = BaSO4 +2NaCl
- 14. Получение солей: 1. Взаимодействие кислоты с Ме: Zn + 2HCI → ZnCI2 + H2 2. Взаимодействие
- 16. Скачать презентацию








 Химическая технология. Введение
Химическая технология. Введение Щелочные металлы. Периодическая система химических элементов Д.И. Менделеева
Щелочные металлы. Периодическая система химических элементов Д.И. Менделеева Определение качественного состава минеральных вод
Определение качественного состава минеральных вод Хром и его соединения
Хром и его соединения Биоорганическая химия
Биоорганическая химия Растворы. Общие свойства растворов
Растворы. Общие свойства растворов Активные формы кислорода. Антиоксиданты их физиологическая роль
Активные формы кислорода. Антиоксиданты их физиологическая роль Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Фенолы+
Фенолы+ Природні гази
Природні гази Вирощування кристалів в додомашніх умовах
Вирощування кристалів в додомашніх умовах Неомыляемые липиды. Изопреноиды
Неомыляемые липиды. Изопреноиды Химическая очистка сточных вод. Окисление и восстановление
Химическая очистка сточных вод. Окисление и восстановление Железо и его соединения
Железо и его соединения Химический состав клетки. Неорганические вещества
Химический состав клетки. Неорганические вещества М.В.Ломоносов о пользе стекла
М.В.Ломоносов о пользе стекла Хімічні властивості алкенів
Хімічні властивості алкенів Закономірності протікання хімічних реакцій
Закономірності протікання хімічних реакцій Фосфонсірке қышқылының антипирендік қасиеттерін зерттеу
Фосфонсірке қышқылының антипирендік қасиеттерін зерттеу Термический анализ. Прибор синхронного термического анализа
Термический анализ. Прибор синхронного термического анализа Месторождения турмалина
Месторождения турмалина Уравнения химических реакций
Уравнения химических реакций Кальцій
Кальцій Соединения азота. Оксиды азота
Соединения азота. Оксиды азота Электролитическая диссоциация. 9 класс
Электролитическая диссоциация. 9 класс Химические методы синтеза наночастиц
Химические методы синтеза наночастиц Супрамолекулярные системы – мост между неживой и живой материей
Супрамолекулярные системы – мост между неживой и живой материей Анализ качества лекарственных средств органической природы из группы галогенпроизводных углеводородов жирного ряда
Анализ качества лекарственных средств органической природы из группы галогенпроизводных углеводородов жирного ряда