Содержание
- 2. Проблемы получения наночастиц Большая площадь поверхности: высокая поверхностная энергия Распределения: размер, состав, морфология, структура. Устойчивость: агломерация,
- 3. Принципы получения наночастиц «Сверху вниз» Уменьшение размера измельчением, травлением и т.д. Размол в мельницах, литография Ухудшение
- 4. Разделение по признаку среды роста Газовая фаза Испарение, распыление, сжигание, разложение паров, пиролиз и т.д. Жидкая
- 5. Механизмы роста
- 6. Зародышеобразование
- 7. Зародышеобразование
- 8. Процессы в растворах («мягкая химия») Контролируемые условия Определяющие факторы Концентрация Растворимость Электростатические взаимодействия Необходимость пассивации Предотвращение
- 9. Синтез в микрореакторах Наноразмерное ограничение пространства Ограничение количества вещества Ограничение размера частиц 0D, 1D, 2D, 3D
- 10. Метод обратных мицелл Обратные мицеллы - микрокапли (мицеллы) воды распределенные в другой жидкости – подходящем органическом
- 11. Поверхностно-активные вещества Молекулы ПАВ (а), их ориентация на границе раздела фаз (б) и образование обратной мицеллы
- 12. Размеры мицелл Размер меняется линейно с количеством воды, добавленной в систему при постоянном количестве ПАВ Параметр,
- 13. Принцип метода При столкновении мицеллы объединяют свое водное содержимое, и после этого объединенная мицелла снова распадается
- 14. Пористые материалы как реакторы Микропористые – размер поры менее 2 нм Мезопористые – размер пор от
- 15. Пористые материалы Структура пор в типичных цеолитах
- 16. Пористые материалы Молекулярные сита Размер пор от 1,5 до 40 нм Основа –диоксид кремния
- 17. Пористые материалы Анодированный алюминий
- 18. Пористые материалы Пористый кремний Пористые полупроводники
- 19. Пористые материалы
- 20. Синтез в микрореакторах Синтез наночастиц – два условия: Растворы прекурсоров должны смачивать гидрофильную поверхность стенок пор.
- 21. Синтез в микрореакторах Пример – синтез квантовых точек PbS Na2PbO2 + Na2S + 2H2O → PbS↓
- 22. Синтез в микрореакторах Схема процесса получения нанонитей Электронно-микроскопический снимок нанонитей железа, полученных в пористом оксиде алюминия
- 23. Синтез наночастиц в растворах Зарождение кристаллов во всем объеме Т/Д и кинетические харктеристики Широкие распределения по
- 24. Сравнение методов
- 25. Сравнение методов
- 26. Метод горячего впрыска В предварительно разогретый растворитель с необходимыми добавками впрыскивают холодный раствор прекуросора Реакции проводят
- 27. Метод горячего впрыска Стабилизация частиц Регулятор процесса роста нанокристаллов Зависимость концентрации кадмия в растворе от времени
- 28. Осаждение из водных растворов Обычно промежуточные компоненты реакций Разбавленные растворы – малое пересыщение, быстрые реакции Продукт
- 29. Сольвотермальный синтез наночастиц Высокая температура Высокое давление Наночастицы металлов, оксидов, халькогенидов, нитридов, фосфидов, гибридные материалы и
- 30. Сольвотермальный синтез наночастиц Синтез гидроксоапатита (обычные методы - аморфный)
- 31. Сольвотермальный синтез наночастиц Изменение химических свойств растворителя при высоких температурах органические растворители, высокая температура - восстановительные
- 32. Сольвотермальный синтез наночастиц Сверхкритические жидкости - диэлектрическая проницаемость, плотность растворов, вязкость и коэффициент диффузии СКВ -
- 33. Сольвотермальный синтез наночастиц Нанокристаллы сложных оксидов алюмоиттриевый гранат Al5Y3O12 673К и 30МПа Al(NO3)3, (YNO3)3, щелочной раствор
- 34. Сонохимический синтез наночастиц Применение ультразвука для синтеза частиц Области сжатия и разрежения при распространении звуковой волны
- 35. Сонохимический синтез наночастиц
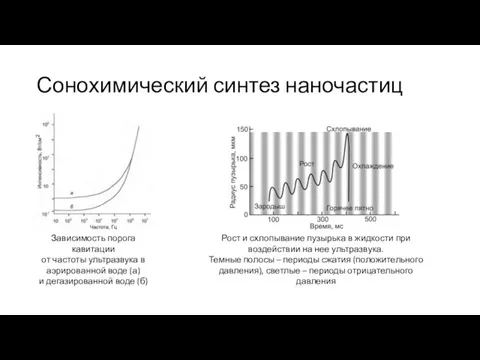
- 36. Сонохимический синтез наночастиц Зависимость порога кавитации от частоты ультразвука в аэрированной воде (а) и дегазированной воде
- 37. Сонохимический синтез наночастиц Рост пузырька Разность давлений – коллапс Ударная волна в центре 5000…30000К, 5⋅107…108Па, охлаждение
- 38. Сонохимический синтез наночастиц ≈20 кГц ≈ 50 Вт/см2 Термостатирование Контроль атмосферы Обычно - процессы разложения, прежде
- 39. Сонохимический синтез наночастиц Разложение карбонилов и нитрозилов металлов в органических растворителях Fe(CO)5, Co(CO)3NO Обработка водных растворов
- 40. Микроволновой синтез наночастиц Скорости нагрева среды до 1К/с
- 41. Микроволновой синтез наночастиц Принцип нагрева – диэлектрические потери Преимущества: Нагрев во всем объеме Быстрый нагрев Чистота
- 42. Микроволновой синтез наночастиц
- 44. Скачать презентацию








































 Инструментальные методы исследования органических веществ
Инструментальные методы исследования органических веществ III А – топтың элементтері
III А – топтың элементтері Удивительные свойства воды
Удивительные свойства воды Гидролиз солей (11 класс)
Гидролиз солей (11 класс) Кристаллизация. Структура жидких металлов
Кристаллизация. Структура жидких металлов Глюкоза. Хімічні властивості глюкози. Сахароза, гідроліз
Глюкоза. Хімічні властивості глюкози. Сахароза, гідроліз Алкены. Строение алкенов, характерные типы химических реакций
Алкены. Строение алкенов, характерные типы химических реакций Кремнийдің құрамы, құрылысы және қасиеттері
Кремнийдің құрамы, құрылысы және қасиеттері Защита от коррозии каменных и бетонных строительных материалов и конструкций
Защита от коррозии каменных и бетонных строительных материалов и конструкций Химиялық элемент оттегі
Химиялық элемент оттегі Теплота горения
Теплота горения Закон сохранения массы веществ. Химические уравнения
Закон сохранения массы веществ. Химические уравнения Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Фенолдар, аминдер, альдегидтер
Фенолдар, аминдер, альдегидтер СФ- И ЯМР-ИССЛЕДОВАНИЕ РЕДОКС-ПРОЦЕССОВ В СИСТЕМЕ Со(II)-ЭДТА-H2O2
СФ- И ЯМР-ИССЛЕДОВАНИЕ РЕДОКС-ПРОЦЕССОВ В СИСТЕМЕ Со(II)-ЭДТА-H2O2 Кислород. Общая характеристика, получение и свойства
Кислород. Общая характеристика, получение и свойства Некоторые d-элементы
Некоторые d-элементы Пенообразование в растворах поверхностно-активных веществ. Лекция 13
Пенообразование в растворах поверхностно-активных веществ. Лекция 13 Ендотермічні реакції на службі людини
Ендотермічні реакції на службі людини Неоднородные системы, их классификация, методы разделения. Лекция 4
Неоднородные системы, их классификация, методы разделения. Лекция 4 Химические свойства солей
Химические свойства солей Хімічні явища, їх ознаки
Хімічні явища, їх ознаки Особенности органических веществ. Классификация органических соединений. 9 класс
Особенности органических веществ. Классификация органических соединений. 9 класс Разработка проектных решений по переводу паровых котлов электростанций в конденсационный режим с целью увеличения кпд котла
Разработка проектных решений по переводу паровых котлов электростанций в конденсационный режим с целью увеличения кпд котла Алюминий. Определите элемент
Алюминий. Определите элемент 20230219_prezentatsiya_k_uroku_neft
20230219_prezentatsiya_k_uroku_neft 20231028_kislorod
20231028_kislorod Материаловедение и технологии конструкционных материалов
Материаловедение и технологии конструкционных материалов