Содержание
- 2. Гидролиз солей – это обменная реакция соли с водой, в результате которой образуется слабый электролит. В
- 3. Факторы, влияющие на гидролиз При повышении температуры гидролиз усиливается. При уменьшении концентрации соли, гидролиз усиливается (для
- 4. Если соль образована слабым многокислотным основанием и сильной кислотой или сильным основанием и слабой многоосновной кислотой,
- 5. Фотосинтез pH = 8 слабощелочная среда
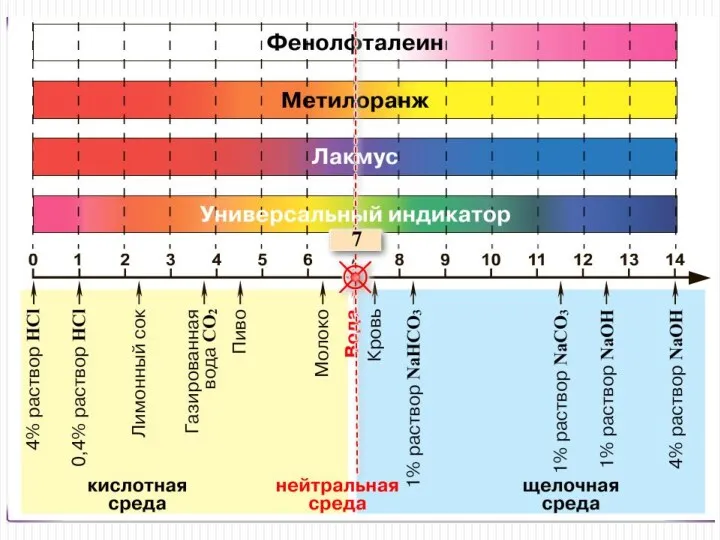
- 6. Универсальный индикатор pH pH = 7 нейтральная среда pH > 7 щелочная среда
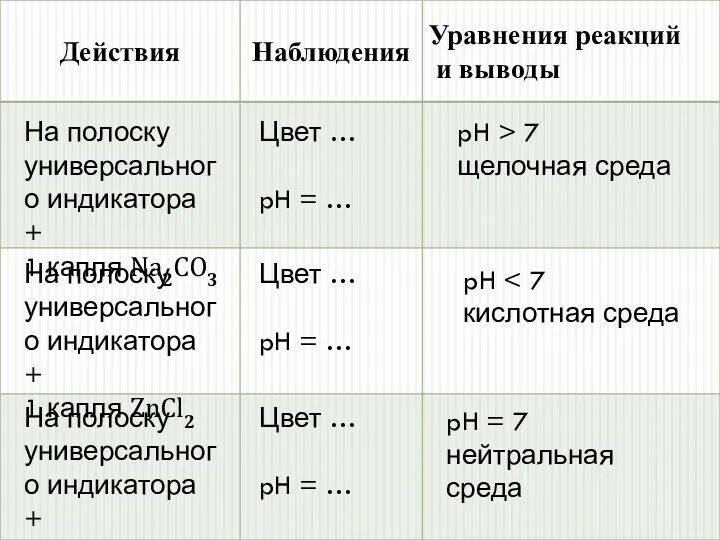
- 8. На полоску универсального индикатора + 1 капля Na2CO3 Цвет … pH = … pH > 7
- 9. Классификация солей Все соли в зависимости от природы образующих ее катиона и аниона можно разделить на
- 10. Сильные электролиты (α > 30%) HI, HBr, HCl HClO4, HMnO4 H2SO4, HNO3 Щелочи: LiOH, NaOH, KOH,
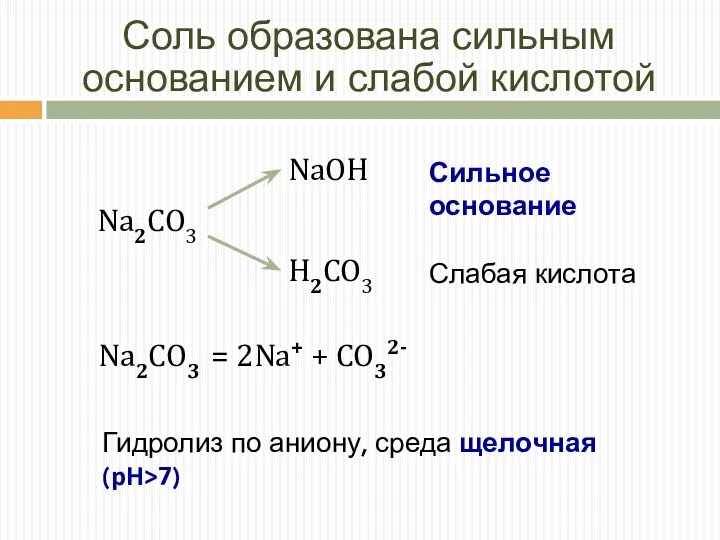
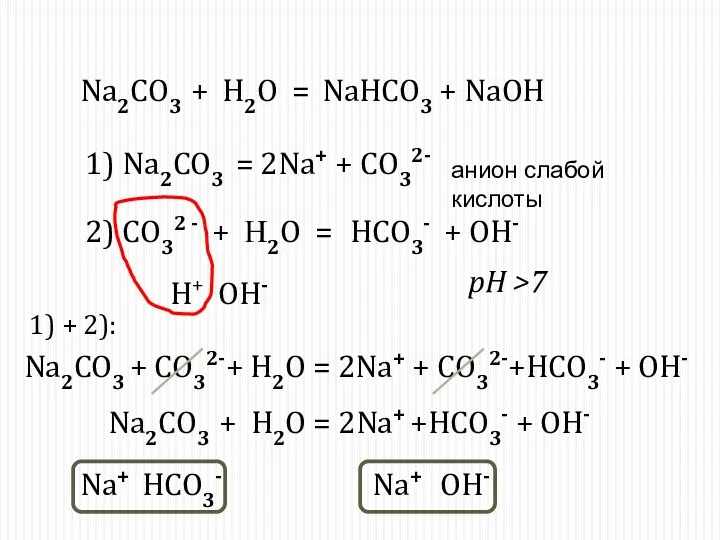
- 11. Соль образована сильным основанием и слабой кислотой Слабая кислота Сильное основание Na2CO3 = 2Na+ + CO32-
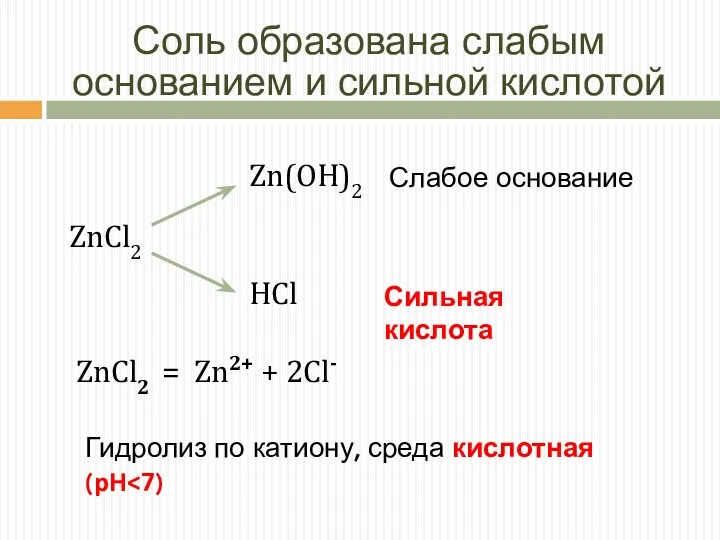
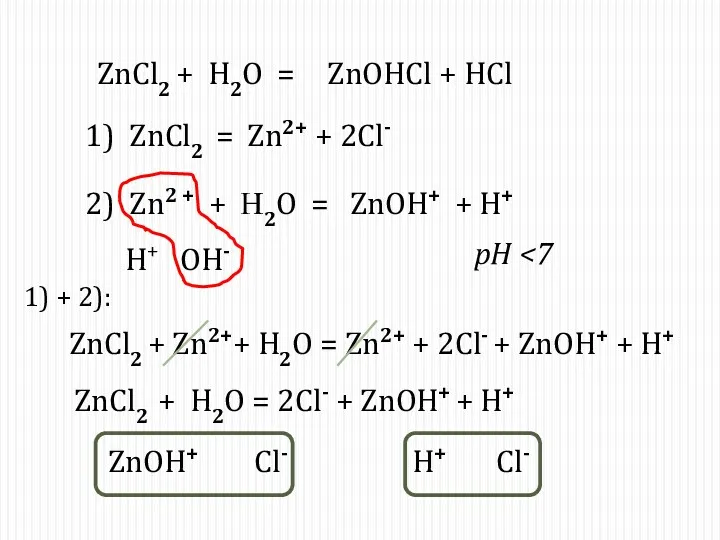
- 12. Соль образована слабым основанием и сильной кислотой Слабое основание Сильная кислота ZnCl2 = Zn2+ + 2Cl-
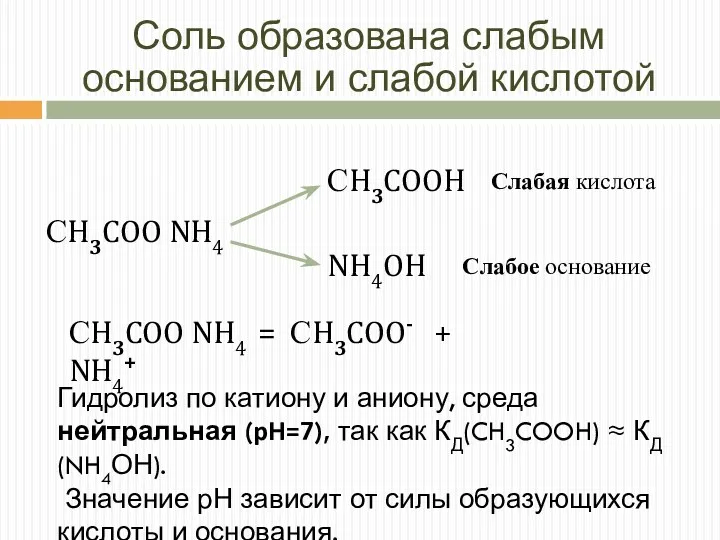
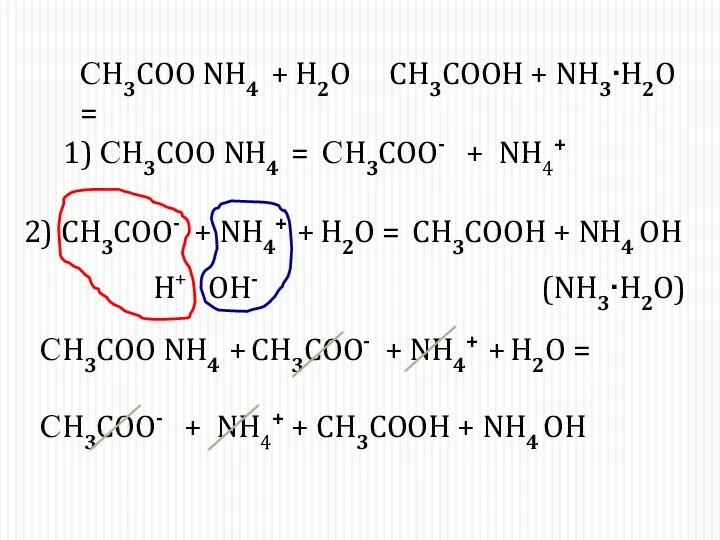
- 13. Соль образована слабым основанием и слабой кислотой Слабая кислота Слабое основание СH3COO NH4 = СH3COO- +
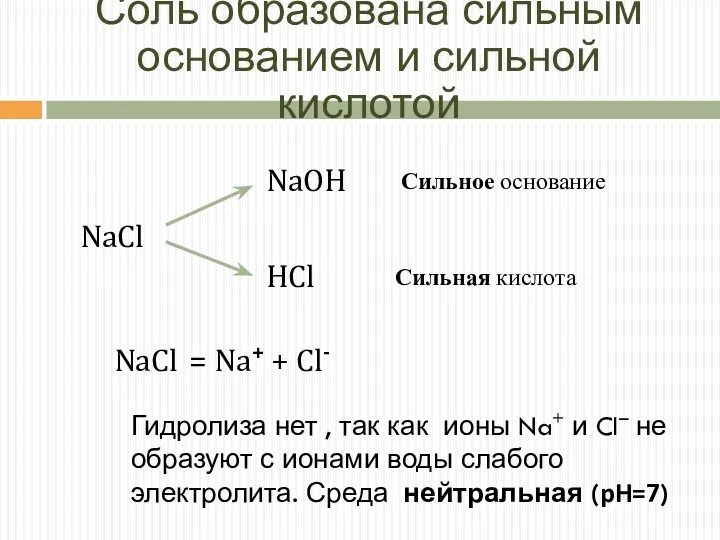
- 14. Соль образована сильным основанием и сильной кислотой Сильное основание Сильная кислота NaCl = Na+ + Cl-
- 15. Na2CO3 + H2O = 1) Na2CO3 = 2Na+ + CO32- 2) CO32 - + Н2O =
- 16. ZnCl2 + H2O = 1) ZnCl2 = Zn2+ + 2Cl- 2) Zn2 + + Н2O =
- 17. 1) СH3COO NH4 = СH3COO- + NH4+ СH3COO NH4 + H2O = 2) CH3COO- + NH4+
- 18. Задание 1 Кислотная среда (pH 1)Na3PO4 2)KCl 3)Na2CO3 4)ZnSO4
- 19. Задание 2 Щелочная среда (pH>7) в растворе: 1)CuBr2 2)NaCl 3)K2CO3 4)MgSO4
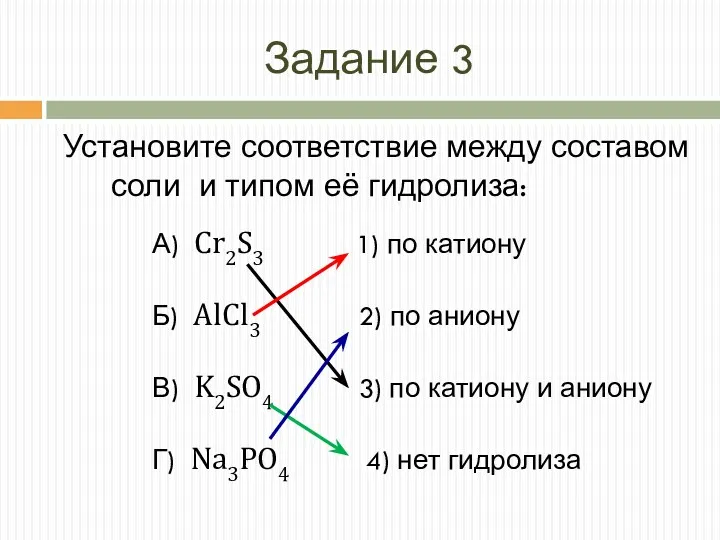
- 20. Задание 3 А) Cr2S3 1) по катиону Б) AlCl3 2) по аниону В) K2SO4 3) по
- 22. Скачать презентацию









 Кинетика химических реакций. Химическое равновесие
Кинетика химических реакций. Химическое равновесие Химические процессы зоны гипергенеза
Химические процессы зоны гипергенеза Амінокислоти. Білки як біологічні полімери. Денатурація білка. Біологічна роль амінокислот та білків. 9 клас
Амінокислоти. Білки як біологічні полімери. Денатурація білка. Біологічна роль амінокислот та білків. 9 клас Альдольные реакции енолятов
Альдольные реакции енолятов Будова та властивості твердих тіл. Анізотропія кристалів. Рідкі кристали
Будова та властивості твердих тіл. Анізотропія кристалів. Рідкі кристали Чистые вещества и смеси (продолжение)
Чистые вещества и смеси (продолжение) Амины. Анилин
Амины. Анилин Растворы электролитов
Растворы электролитов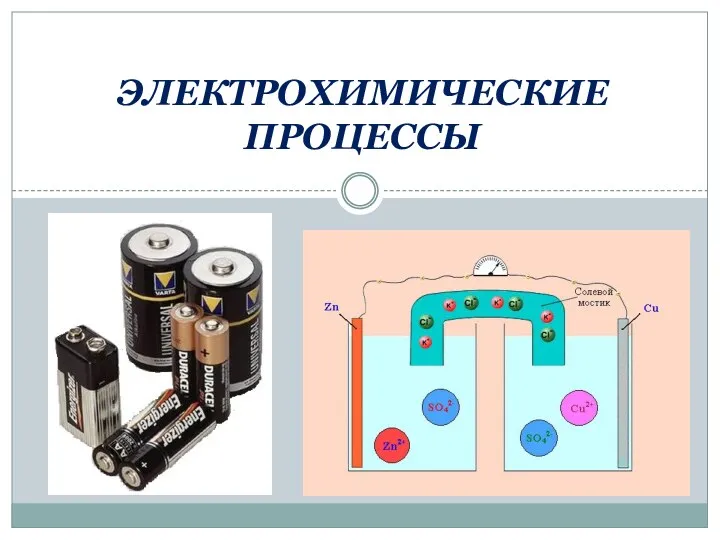 Электрохимические процессы
Электрохимические процессы Гідроліз солей
Гідроліз солей Понятие о единичных и симметрично-равных направлениях
Понятие о единичных и симметрично-равных направлениях Типичные окислители
Типичные окислители БАЗ-дың заманауи, ғылыми классификациясы. 3 Лекция
БАЗ-дың заманауи, ғылыми классификациясы. 3 Лекция Основания. Неорганические соединения
Основания. Неорганические соединения Химические волокна. Полиэфирные волокна. Лавсан
Химические волокна. Полиэфирные волокна. Лавсан Хром. Элемент под № 24
Хром. Элемент под № 24 Алкадиены. Циклоалканы. Лекция № 5
Алкадиены. Циклоалканы. Лекция № 5 Неметаллы. Общая характеристика неметаллов
Неметаллы. Общая характеристика неметаллов Соли. Классификация. Физические и химические свойства солей
Соли. Классификация. Физические и химические свойства солей Химическая связь
Химическая связь Мир камня. Чувашский национальный музей
Мир камня. Чувашский национальный музей Elements of group 2 (IIA)
Elements of group 2 (IIA) Причина отказа повреждений технологического оборудования и принятия мер по их устранению установки производства газовой серы
Причина отказа повреждений технологического оборудования и принятия мер по их устранению установки производства газовой серы Сформировать понятие о химическом составе пищи
Сформировать понятие о химическом составе пищи Электролитическая диссоциация
Электролитическая диссоциация Лекция 4. Классификация и механизмы органических реакций
Лекция 4. Классификация и механизмы органических реакций Строение вещества и агрегатные состояния вещества
Строение вещества и агрегатные состояния вещества Позднемеловая трубка взрыва щелочных базальтов Красноозерная
Позднемеловая трубка взрыва щелочных базальтов Красноозерная