Содержание
- 2. Оборотні та необоротні реакції Реакції, які за певних умов відбуваються переважно тільки в одному напрямку, є
- 3. Принцип зміщення хімічної рівноваги Ле Шательє: якщо на систему, яка знаходиться в хімічній рівновазі, вчинити зовнішній
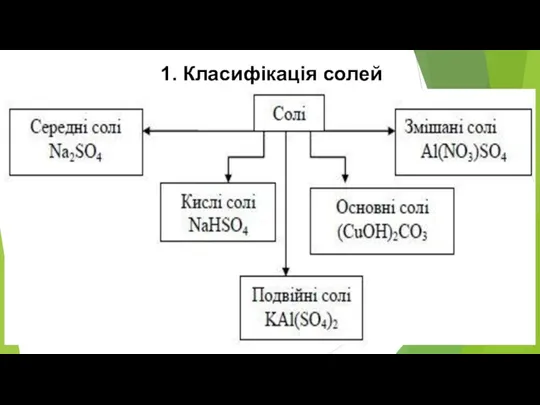
- 4. 1. Класифікація солей
- 5. Середні солі Середні солі складаються тільки з катіонів металічних елементів та аніонів повністю дисоційованих кислот, наприклад:
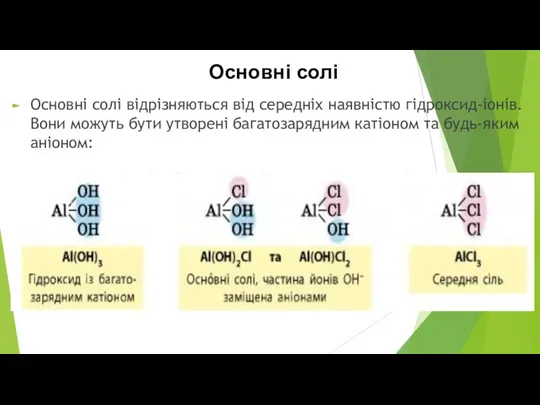
- 6. Основні солі Основні солі відрізняються від середніх наявністю гідроксид-іонів. Вони можуть бути утворені багатозарядним катіоном та
- 7. Кислі солі Кислі солі відрізняються від середніх наявністю Гідрогену. Вони можуть бути утворені будь-яким катіоном, а
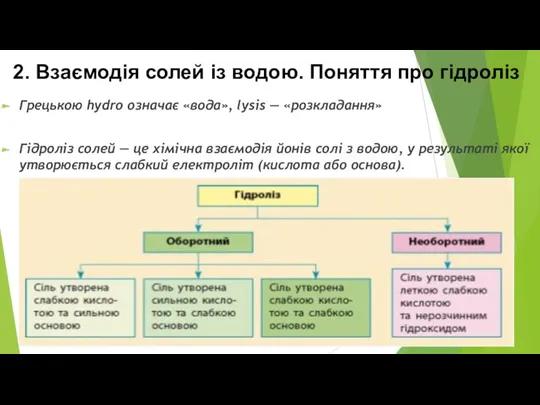
- 8. 2. Взаємодія солей із водою. Поняття про гідроліз Грецькою hydro означає «вода», lysis — «розкладання» Гідроліз
- 9. 3. Гідроліз солей, утворених слабкими кислотами та сильними основами
- 10. Сіль, утворена сильною основою та слабкою кислотою, піддається гідролізу за аніоном, а її розчин має лужне
- 11. 4. Гідроліз солей, утворених сильними кислотами та слабкими основами
- 12. Сіль, утворена слабкою основою та сильною кислотою, піддається гідролізу за катіоном, а її розчин має кислотне
- 13. 5. Гідроліз солей, утворених слабкими кислотами та слабкими основами
- 14. Сіль, утворена слабкою основою та слабкою кислотою, піддається гідролізу як за катіоном, так і за аніоном.
- 15. 6. Сіль, утворена сильною кислотою та сильною основою Але обидва продукти реакції є сильними електролітами і
- 16. Сіль, утворена сильною основою та сильною кислотою, гідролізу не піддається, а в її розчині нейтральне середовище,
- 17. 7. Необоротний гідроліз Солі, утворені леткою слабкою кислотою та нерозчинним у воді гідроксидом, піддаються необоротному гідролізу
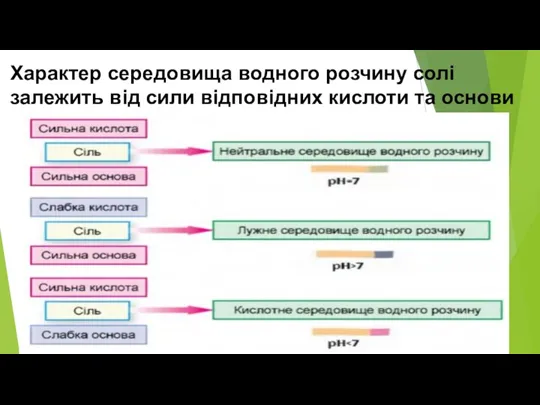
- 18. Характер середовища водного розчину солі залежить від сили відповідних кислоти та основи
- 19. ЛАБОРАТОРНИЙ ДОСЛІД № 1 Визначення pH середовища водних розчинів солей за допомогою індикаторів Обладнання: штатив із
- 20. 1. Забарвлення універсального індикатора у водному розчині натрій карбонату 2. Забарвлення універсального індикатора у водному розчині
- 21. 1. Польові шпати, зокрема ортоклаз (KAlSi3O8), - найпоширеніші породотвірні мінерали, масова частка яких у земній корі
- 22. Якщо вирощувати гортензію на ділянці, де рівень pH ґрунту становить 6,0-6,2, то на рослині розцвітуть рожеві
- 23. Із переліку речовин випишіть окремо формули солей, які: а) піддаються оборотному гідролізу; б) піддаються необоротному гідролізу;
- 25. Скачать презентацию


















 Химическая термодинамика
Химическая термодинамика Иондық байланыс
Иондық байланыс Общее понятие напряженно – деформированного состояния деталей машин из металлических материалов, применяемых в машиностроении
Общее понятие напряженно – деформированного состояния деталей машин из металлических материалов, применяемых в машиностроении Нафта. Класифікація нафти
Нафта. Класифікація нафти Строение и свойства металлов. Физические и механические свойства металлов
Строение и свойства металлов. Физические и механические свойства металлов Полисахариды. Крахмал
Полисахариды. Крахмал Кристаллические и аморфные тела
Кристаллические и аморфные тела Растворы. Способы выражения концентрации раствора
Растворы. Способы выражения концентрации раствора Химия элементов IVA группы
Химия элементов IVA группы Механизм и закономерности кристаллизации металлов
Механизм и закономерности кристаллизации металлов Химическая связь
Химическая связь Галогены
Галогены Органикалық қосылыстардың химиялық құрылыс теориясы, органикалық қосылыстардың структурасы және қосылыстары
Органикалық қосылыстардың химиялық құрылыс теориясы, органикалық қосылыстардың структурасы және қосылыстары Литий. Физические свойства лития
Литий. Физические свойства лития Применение серной кислоты
Применение серной кислоты Электрохимические методы анализа. Кондуктометрия. Электрофорез
Электрохимические методы анализа. Кондуктометрия. Электрофорез Химическая связь в кластерах
Химическая связь в кластерах Состав, строение и свойства аминокислот
Состав, строение и свойства аминокислот Зародження періодичної системи елементів Менделєєва
Зародження періодичної системи елементів Менделєєва Биохимия
Биохимия Углерод. Положение в периодической системе и строение атома
Углерод. Положение в периодической системе и строение атома La notion de catabolisme et d’anabolisme. La bioenergetique. La chaine mitochondriale de transfert d’electrons
La notion de catabolisme et d’anabolisme. La bioenergetique. La chaine mitochondriale de transfert d’electrons Химический состав водоотталкивающих средств
Химический состав водоотталкивающих средств Химические реакции
Химические реакции Химический элемент радий
Химический элемент радий Кинетика химических реакций и химическое равновесие
Кинетика химических реакций и химическое равновесие Основные классы неорганических соединений
Основные классы неорганических соединений Возникновение и развитие органической химии. Теория химического строения. Структурные формулы
Возникновение и развитие органической химии. Теория химического строения. Структурные формулы