Содержание
- 2. Цель урока Познакомиться с составом, строением и свойствами аминокислот Закрепить знания о свойствах аминов Повторить свойства
- 3. Содержание Определение Строение Классификация Номенклатура Изомерия Физические свойства Химические свойства Получение Применение
- 4. Определение Аминокислоты – бифункциональные соединения, которые обязательно содержат две функциональные группы: аминогруппу – NH2 и карбоксильную
- 5. Строение Общая формула (NH2)mR(COOH)n, где m и n чаще всего равны 1 или 2. таким образом,
- 6. Классификация По числу функциональных групп: По взаимному расположению карбоксильной и аминогруппы По строению углеводородного радикала Аминокислоты
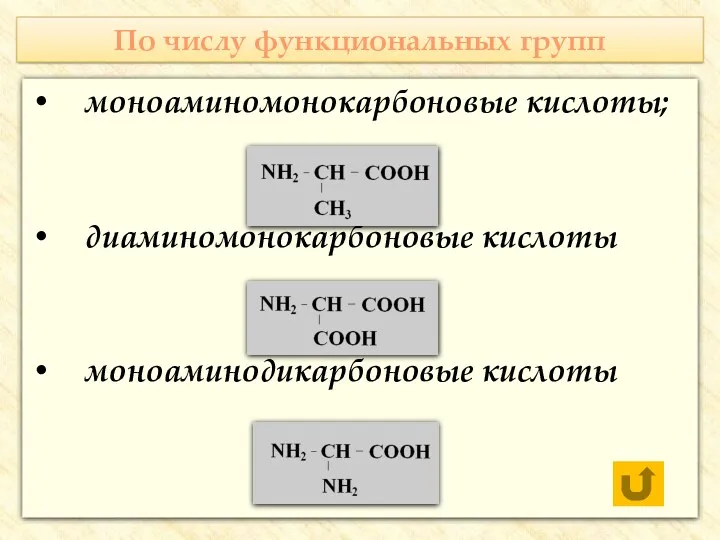
- 7. По числу функциональных групп моноаминомонокарбоновые кислоты; диаминомонокарбоновые кислоты моноаминодикарбоновые кислоты
- 8. По взаимному расположению карбоксильной и аминогруппы α –аминокислоты, β – аминокислоты, γ- аминокислоты, δ – аминокислоты,
- 9. По строению углеводородного радикала Предельные Непредельные Циклические Ароматические
- 10. Аминокислоты делят на: Природные Их около 150, они были обнаружены в живых организмах, около 20 из
- 11. Аминокислоты организма АМИНОКИСЛОТЫ Заменимые Синтезируются в организме человека Незаменимые Не синтезируются в организме человека
- 12. Номенклатура Систематическая Рациональная Тривиальное
- 13. Систематическая номенклатура выбрать самую длинную цепь содержащую карбоксильную группу и аминогруппу; пронумеровать начиная с углерода карбоксильной
- 14. Рациональная номенклатура По рациональной номенклатуре положение аминогруппы указывается буквами греческого алфавита, начиная со второго атома углерода
- 15. Тривиальные названия Многие аминокислоты имеют тривиальные названия, например: Аланин
- 16. Изомерия Изомерия углеродного скелета; Изомерия положения функциональных групп; Межклассовая изомерия с нитросоединениями; Оптическая изомерия;
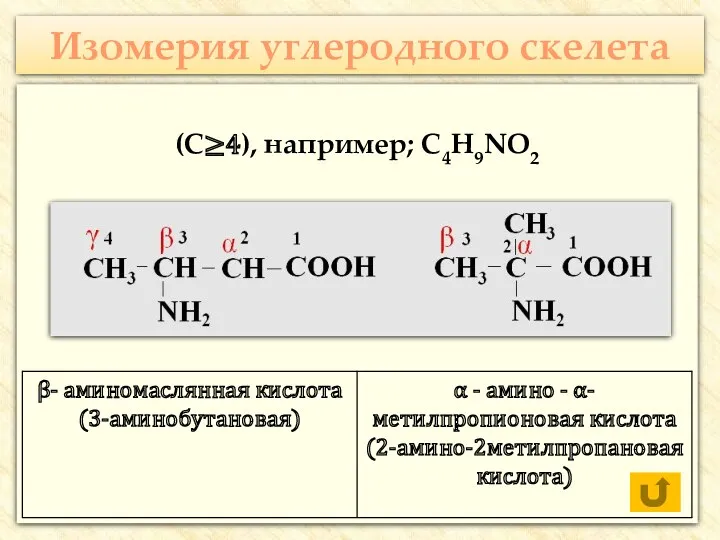
- 17. Изомерия углеродного скелета (С≥4), например; С4H9NO2
- 18. Изомерия положения функциональных групп (С≥3), например; С3H7NO2
- 19. Межклассовая с нитросоединениями (С≥2), например; С3H7NO2
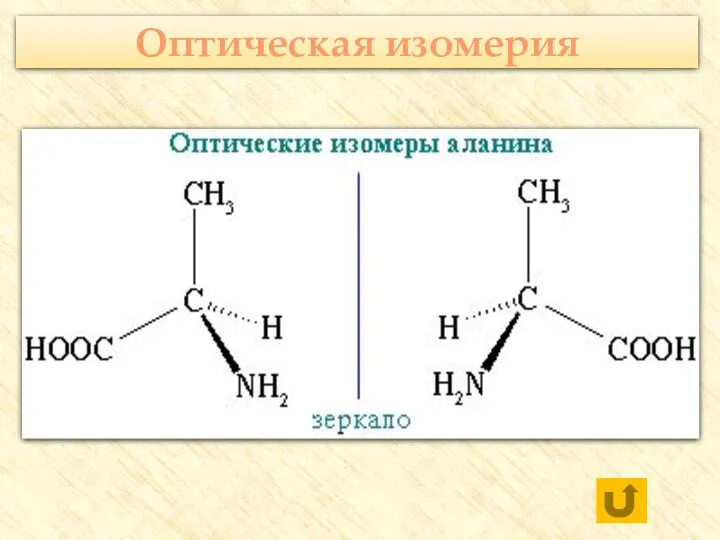
- 20. Оптическая изомерия
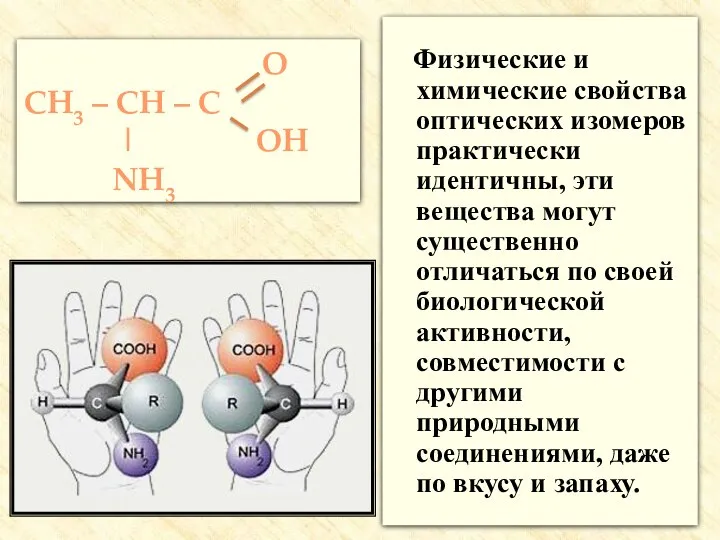
- 21. Физические и химические свойства оптических изомеров практически идентичны, эти вещества могут существенно отличаться по своей биологической
- 22. Физические свойства Аминокислоты – бесцветные кристаллические вещества с высокими температурами плавления. Плавятся с разложением, нелетучие. Хорошо
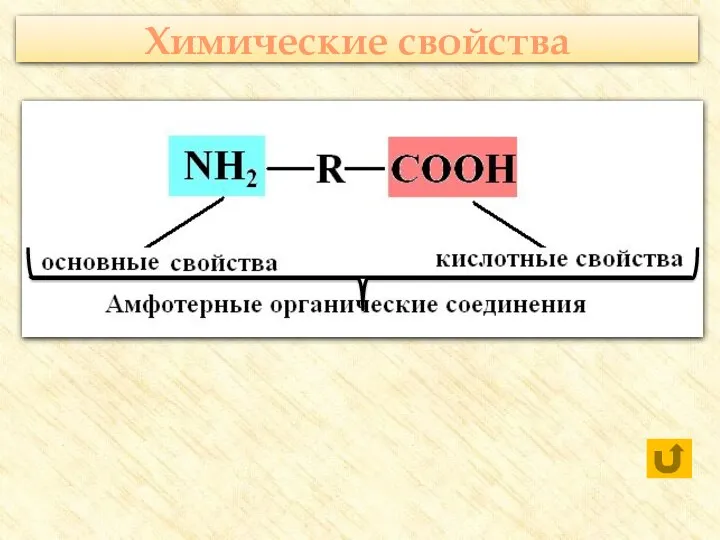
- 23. Химические свойства
- 24. Реакции с участием карбоксильной группы С активными металлами Оксидами металлов Гидроксидами металлов С солями слабых летучих
- 25. 1. Mg + 2NH2 – CH2 – COOH → (NH2 – CH2 – COO)2Mg + H2
- 26. Реакции с участием аминогруппы Взаимодействуют с кислотами: H2N–CH2–COOH + HCl → [H3N+–CH2–COOH] Cl-
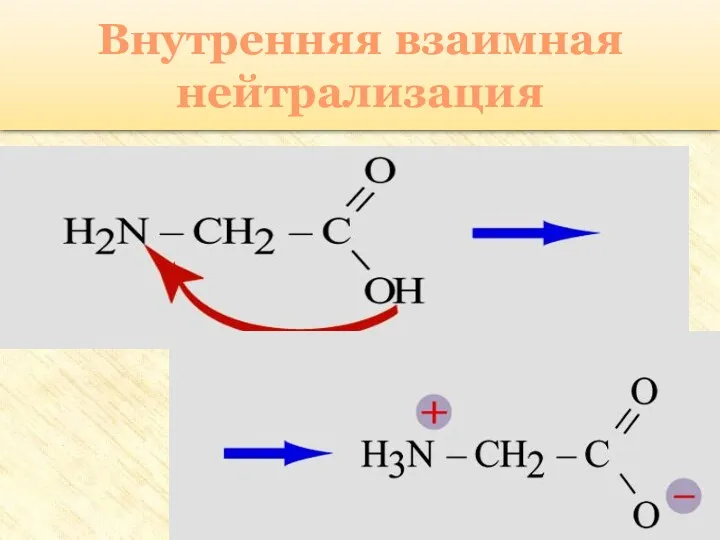
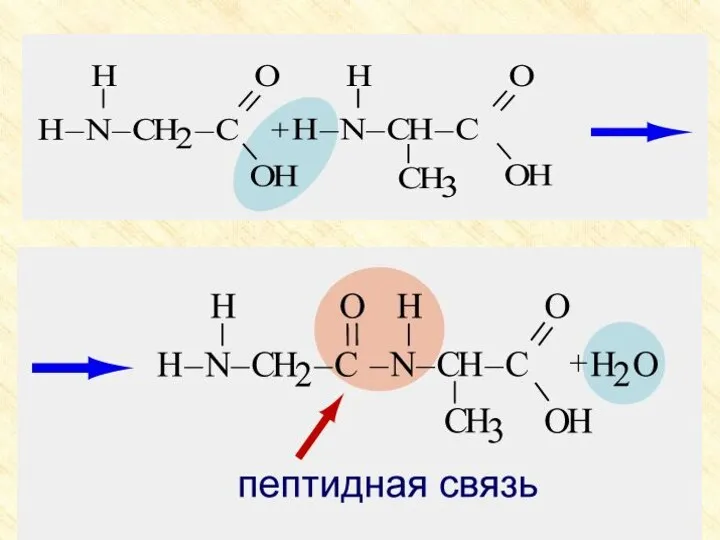
- 27. Особые свойства аминокислот Образование внутренней соли при диссоциации NH2 – CH2 – COOH ⇄ +NH3 –
- 28. Внутренняя взаимная нейтрализация
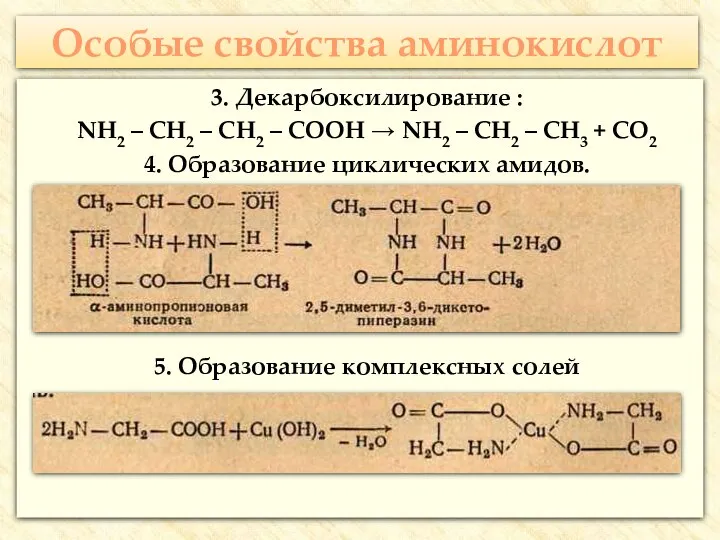
- 30. Особые свойства аминокислот 3. Декарбоксилирование : NH2 – CH2 – CH2 – COOH → NH2 –
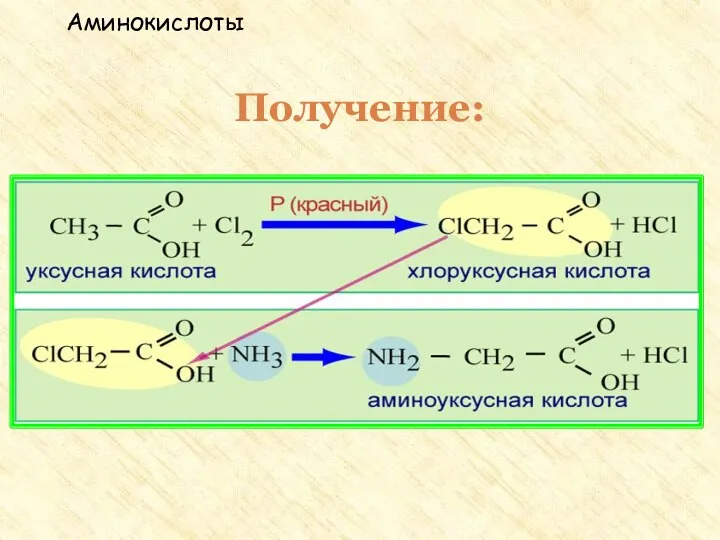
- 31. Получение аминокислот Гидролиз белков под влиянием ферментов, кислот или щелочей. Действие аммиака на хлорзамещенные органические кислоты:
- 32. Получение: 1. Гидролиз белков. Белок – полимер под действием воды распадается на мономеры - аминокислоты Аминокислоты
- 33. Применение аминокислот Аминокислоты Лекарства Глутаминовая кислота, анестезин, новокаин, п-аминосалициловая кислота Синтетические волокна Капрон Пищевая промышленность Глутамат
- 34. Задание № 1. Определить пары изомеров и назвать их.
- 35. Задача. Определите формулу аминокислоты, если массовые доли углерода, водорода, кислорода и азота соответственно равны: 48%, 9,34%,
- 37. Скачать презентацию



















![Реакции с участием аминогруппы Взаимодействуют с кислотами: H2N–CH2–COOH + HCl → [H3N+–CH2–COOH] Cl-](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/331332/slide-25.jpg)





 Количество вещества. Моль
Количество вещества. Моль Основы органической химии
Основы органической химии Методические рекомендации по изучению курса Коррозия и защита металлов
Методические рекомендации по изучению курса Коррозия и защита металлов Рекомендации по оформлению развёрнутых ответов на задания ЕГЭ
Рекомендации по оформлению развёрнутых ответов на задания ЕГЭ Кремний. Применение кремния
Кремний. Применение кремния Титанның химиялық элементі
Титанның химиялық элементі Твердое состояние вещества. Плавление
Твердое состояние вещества. Плавление Химиядан сұрақтар
Химиядан сұрақтар Кислород. Атом кислорода
Кислород. Атом кислорода Природные источники углеводородов
Природные источники углеводородов Қатты күйдегі препараттар
Қатты күйдегі препараттар Радиусы атомов и ионов
Радиусы атомов и ионов Теорія горіння та вибуху
Теорія горіння та вибуху Химия. Изучение жиров
Химия. Изучение жиров Силикаты. Слюды. Тальк. Фосфаты. Апатит. Крокоит
Силикаты. Слюды. Тальк. Фосфаты. Апатит. Крокоит Индикаторы кислотно-основного титрования
Индикаторы кислотно-основного титрования Solutions and solubilities
Solutions and solubilities Хімічні сполуки у побуті
Хімічні сполуки у побуті Физические, химические свойства предельных и непредельных карбоновых кислот, получение
Физические, химические свойства предельных и непредельных карбоновых кислот, получение Кислородсодержащие органические соединения. Спирты. 10 класс
Кислородсодержащие органические соединения. Спирты. 10 класс Химическая связь
Химическая связь Как и где используется соляная кислота
Как и где используется соляная кислота Виды химической связи
Виды химической связи Вода. Растворимость, растворы
Вода. Растворимость, растворы Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Электролитическая диссоциация кислот, солей и оснований Степень электролитической диссоциации. Сильные и слабые электролиты
Электролитическая диссоциация кислот, солей и оснований Степень электролитической диссоциации. Сильные и слабые электролиты Обмоточные провода
Обмоточные провода Классификация химических реакций
Классификация химических реакций