Слайд 2

Какие типы химических реакций мы знаем?
CaCO3→CaO +CO2
(разложение)
2Ca +O2 →2CaO
(соединение)
Zn +H2 SO4 →ZnSO4+H2
(замещение)
СuO +H2 SO4 →CuSO4+H2O
(обмен)
Слайд 3

Расставьте степени окисления.
Ca+2C+4O3-2→ Ca+2O-2 +C+4O-2
2Ca0+O20→ 2Ca+2O-2
Zn0+H2+1S+6O4-2→ Zn+2S+6O4-2+H20
Cu+2O-2+H2+1S+6O4-2→ Cu+2S+6O4-2
+H2+1O-2
Слайд 4

Реакции идущие без изменения степени окисления:
Ca+2C+4O3-2→ Ca+2O-2 +C+4O-2
Cu+2O-2+H2+1S+6O4-2→ Cu+2S+6O4-2 +H2+1O-2
Реакции
идущие с изменением степени окисления- называются окислительно-восстановительные:
2Ca0+O20→ 2Ca+2O-2
Zn0+H2+1S+6O4-2→ Zn+2S+6O4-2+H20
Слайд 5

Метод электронного баланса.
Составить схему реакций и определить степени окисления.
Zn0+H2+1S+6O4-2→ Zn+2S+6O4-2+H20
Определить элементы
изменившие степени окисления. Составьте электронные уравнения.
Zn0 +2=Zn+2
2H+1 +2= H20
Слайд 6

Метод электронного баланса.
Определите окислитель и восстановитель. Составьте схему электронного баланса.
Zn0 -2=Zn+2
2 1 - окисление
2
2H+1 +2= H20 2 1 - восстановление
Zn0 - восстановитель
H+1 - окислитель
Слайд 7

Процесс отдачи электронов атомом, ионом или молекулой называется окислением.
Процесс присоединения электронов
атомом, ионом или молекулой называется восстановлением.
Вещество атомы, ионы или молекулы которого отдают электроны называются восстановителем.
Вещество атомы, ионы или молекулы которого принимают электроны называются окислителем.
Слайд 8
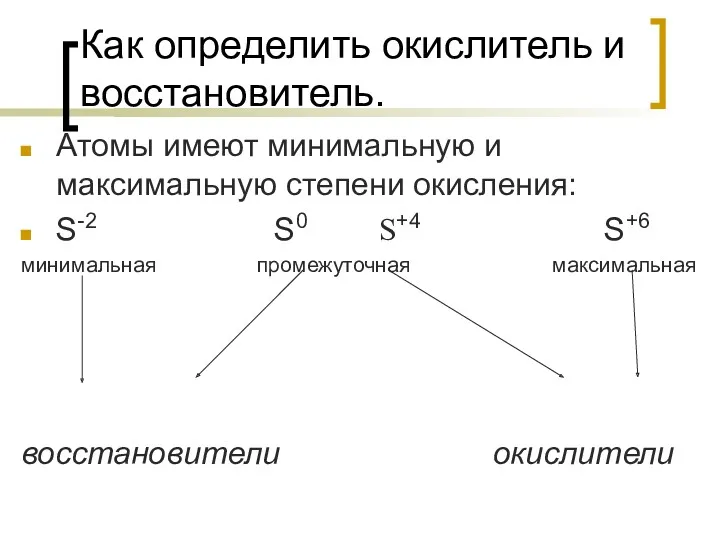
Как определить окислитель и восстановитель.
Атомы имеют минимальную и максимальную степени окисления:
S-2
S0 S+4 S+6
минимальная промежуточная максимальная
восстановители окислители







 Сущность процесса электролитической диссоциации
Сущность процесса электролитической диссоциации Типы химических реакций. Тепловой эффект (11 класс)
Типы химических реакций. Тепловой эффект (11 класс) Азотсодержащие гетероциклические соединения
Азотсодержащие гетероциклические соединения Crystal defects
Crystal defects Классификация минералов по химическому принципу. Кварц, магнетит
Классификация минералов по химическому принципу. Кварц, магнетит Інгібіювання та регуляція ензимів
Інгібіювання та регуляція ензимів Аммиак. Состав вещества
Аммиак. Состав вещества Le trasformazioni fisiche della materia. Tema 3
Le trasformazioni fisiche della materia. Tema 3 Введение в химию
Введение в химию Обмен нуклеотидов
Обмен нуклеотидов Основні технологічні процеси очистки води. Знезараження води. Знезараження води хлором
Основні технологічні процеси очистки води. Знезараження води. Знезараження води хлором Возраст в геологии
Возраст в геологии Соединения щелочных металлов
Соединения щелочных металлов Оксиди: поняття, склад і назви, фізичні властивості, поширеність у природі, використання
Оксиди: поняття, склад і назви, фізичні властивості, поширеність у природі, використання Аммиак. Образование молекулы аммиака
Аммиак. Образование молекулы аммиака Химическая связь. (Лекция 4, 5)
Химическая связь. (Лекция 4, 5) Гетерофункциональные производные бензольного ряда как лекарственные средства
Гетерофункциональные производные бензольного ряда как лекарственные средства Кислородные соединения азота
Кислородные соединения азота Закон сохранения массы веществ. Химические уравнения
Закон сохранения массы веществ. Химические уравнения Метаболизм кетоновых тел. Метаболизм холестерина
Метаболизм кетоновых тел. Метаболизм холестерина Предельные углеводороды
Предельные углеводороды Теория электролитической диссоциации (ТЭД)
Теория электролитической диссоциации (ТЭД) Массообменные процессы
Массообменные процессы Снежинки. Рождение снежинки
Снежинки. Рождение снежинки Аномальные свойства воды
Аномальные свойства воды Алмастырылмайтын аминқышқылды алу биотехнологиясы
Алмастырылмайтын аминқышқылды алу биотехнологиясы Промежуточные фазы в металлических сплавах
Промежуточные фазы в металлических сплавах Моющие и чистящие средства
Моющие и чистящие средства