Содержание
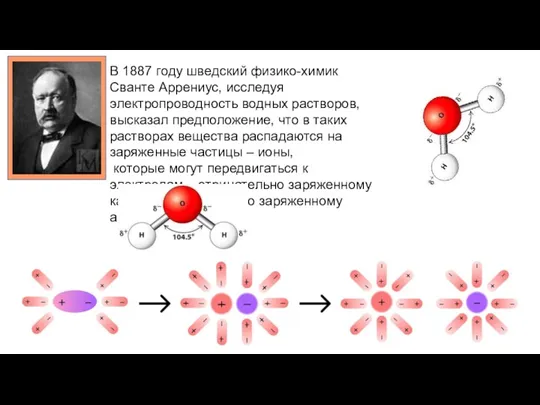
- 2. В 1887 году шведский физико-химик Сванте Аррениус, исследуя электропроводность водных растворов, высказал предположение, что в таких
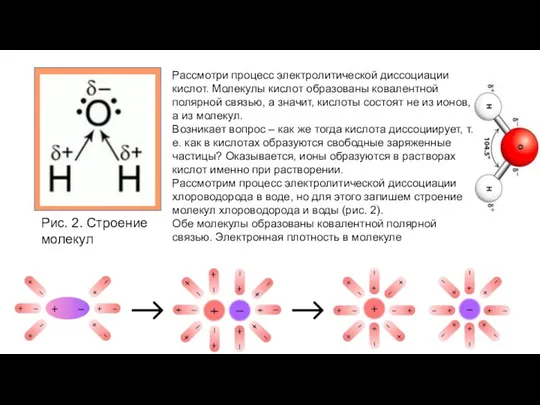
- 3. Рис. 2. Строение молекул хлороводорода и воды Рассмотри процесс электролитической диссоциации кислот. Молекулы кислот образованы ковалентной
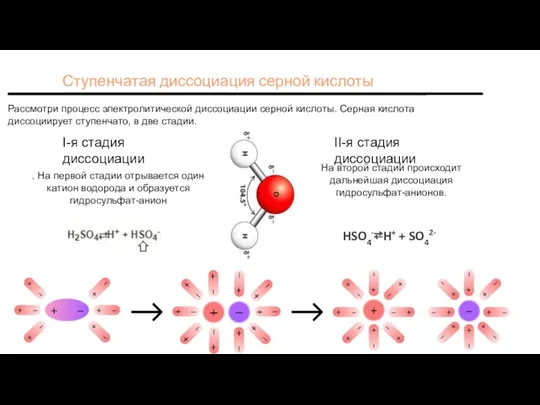
- 4. Ступенчатая диссоциация серной кислоты Рассмотри процесс электролитической диссоциации серной кислоты. Серная кислота диссоциирует ступенчато, в две
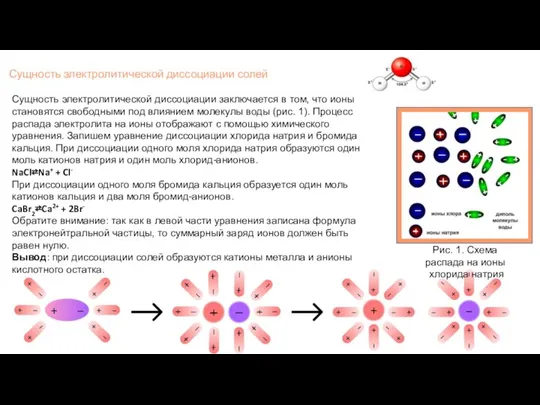
- 5. Сущность электролитической диссоциации солей Рис. 1. Схема распада на ионы хлорида натрия Сущность электролитической диссоциации заключается
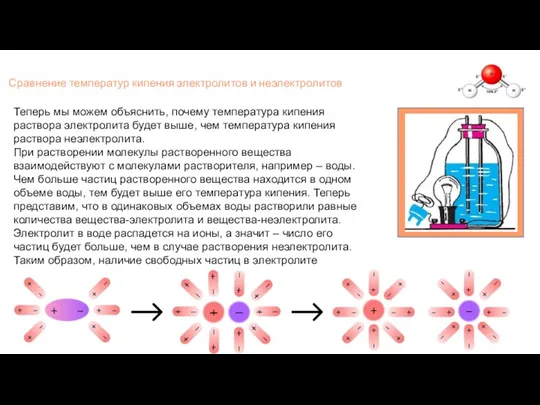
- 6. Сравнение температур кипения электролитов и неэлектролитов Теперь мы можем объяснить, почему температура кипения раствора электролита будет
- 8. Скачать презентацию
 Лекция 1. Введение в биоорганическую химию
Лекция 1. Введение в биоорганическую химию Хімічні властивості кислот
Хімічні властивості кислот Строение электронных оболочек атомов химических элементов 8 класс
Строение электронных оболочек атомов химических элементов 8 класс Алкадиены. Получение и применение алкадиенов
Алкадиены. Получение и применение алкадиенов Потенциометрия
Потенциометрия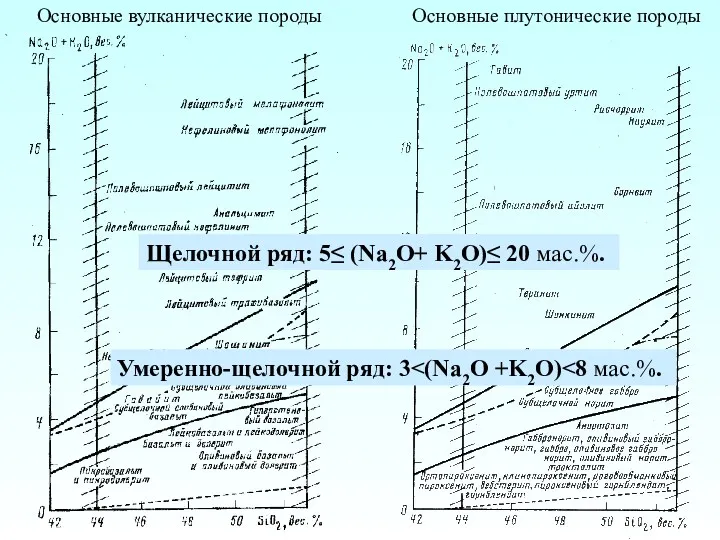 Основные вулканические породы. Основные плутонические породы
Основные вулканические породы. Основные плутонические породы Общие черты гидротермальных месторождений
Общие черты гидротермальных месторождений Химические свойства. Оксиды, основания, кислоты и соли
Химические свойства. Оксиды, основания, кислоты и соли Количество вещества. 8 класс
Количество вещества. 8 класс Металлы и их свойства. Способы получения
Металлы и их свойства. Способы получения Контрольная работа по дисциплине: химия
Контрольная работа по дисциплине: химия Водородные и кислородные соединения неметаллов. Галогеноводороды. Соляная кислота
Водородные и кислородные соединения неметаллов. Галогеноводороды. Соляная кислота Магнитные наночастицы: проблемы и достижения
Магнитные наночастицы: проблемы и достижения Кислоты. Классификация кислот, их химические свойства
Кислоты. Классификация кислот, их химические свойства Применение соляной кислоты и её солей
Применение соляной кислоты и её солей Адсорбция на пористых адсорбентах. Пористость. Методы получения пористых материалов. Лекция 7
Адсорбция на пористых адсорбентах. Пористость. Методы получения пористых материалов. Лекция 7 История открытия химических веществ
История открытия химических веществ Галогены. Астат
Галогены. Астат Химия. ОГЭ
Химия. ОГЭ Кислородсодержащие соединения азота
Кислородсодержащие соединения азота Цинк. Месторождения. Применение
Цинк. Месторождения. Применение Оксиды. Классификация. Номенклатура. Свойства оксидов. Получение. Применение
Оксиды. Классификация. Номенклатура. Свойства оксидов. Получение. Применение Способы разделения смесей
Способы разделения смесей Алкадиены (диеновые углеводороды)
Алкадиены (диеновые углеводороды)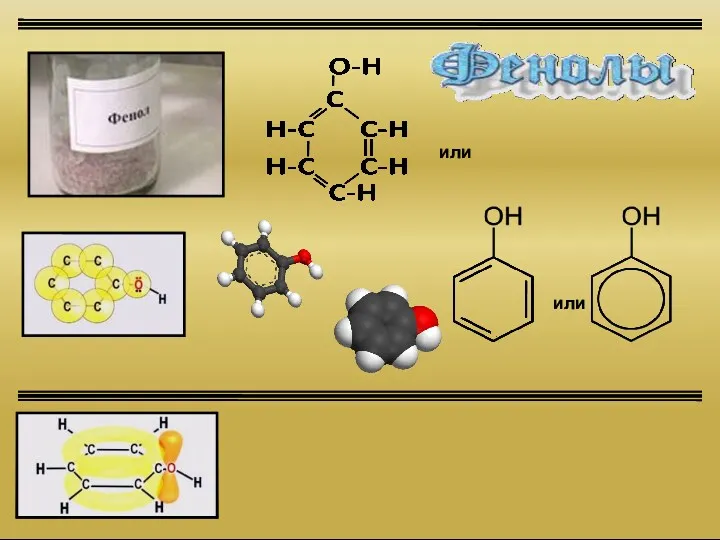 Фенолы
Фенолы Le trasformazioni fisiche della materia. Tema 3
Le trasformazioni fisiche della materia. Tema 3 Свойства минералов
Свойства минералов Гидролиз солей
Гидролиз солей