Слайд 2

Федеральное государственное бюджетное научное учреждение «ФЕДЕРАЛЬНЫЙ ИНСТИТУТ ПЕДАГОГИЧЕСКИХ ИЗМЕРЕНИЙ»
fipi.ru
Слайд 3

В 2018 на выбор органов исполнительной власти субъектов РФ, осуществляющих управление
в сфере образования, предлагается две модели экзаменационной работы.
Каждый вариант экзаменационной работы состоит из двух частей.
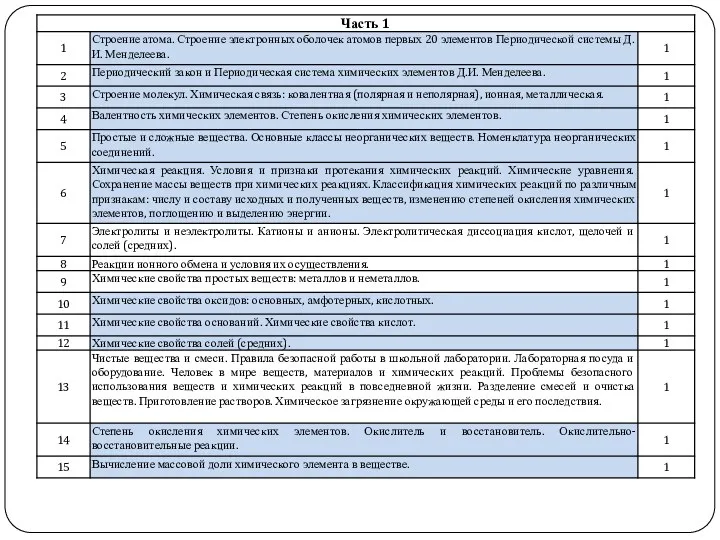
Часть 1 содержит 19 заданий с кратким ответом, в их числе 15 заданий базового уровня сложности и 4 задания повышенного уровня сложности.
При всем своем различии задания этой части сходны в том, что ответ к каждому из них записывается кратко в виде одной цифры или последовательности цифр (двух или трех).
Часть 2 в зависимости от модели КИМ содержит 3 или 4 задания высокого уровня сложности, с развернутым ответом.
Различие экзаменационных моделей 1 и 2 состоит в содержании и подходах к выполнению последних заданий экзаменационных вариантов:
• экзаменационная модель 1 содержит задание 22, предусматривающее выполнение «мысленного эксперимента»;
• экзаменационная модель 2 содержит задания 22 и 23, предусматривающие выполнение лабораторной работы (реального химического эксперимента).
Слайд 4

Проверка ответов учащихся на задания части 1 выполняется экспертами или с
помощью компьютера.
Верное выполнение каждого из заданий 1–15 оценивается 1 баллом. Верное выполненное каждого из заданий 16–19 максимально оценивается 2 баллами.
Проверка заданий части 2 (20–23) осуществляется предметной комиссией. Максимальная оценка за верно выполненное задание: за задания 20 и 21 – по 3 балла; за задание 22 – 5 баллов; за задание 23 – 5 баллов.
Задания с развернутым ответом могут быть выполнены обучающимися разными способами. Это относится, прежде всего, к способам решения расчетных задач.
Слайд 5

На экзамене по химии разрешается использовать следующие материалы и оборудование:
Периодическая
система химических элементов Д.И. Менделеева;
таблица растворимости солей, кислот и оснований в воде;
электрохимический ряд напряжений металлов;
непрограммируемый калькулятор.
Слайд 6
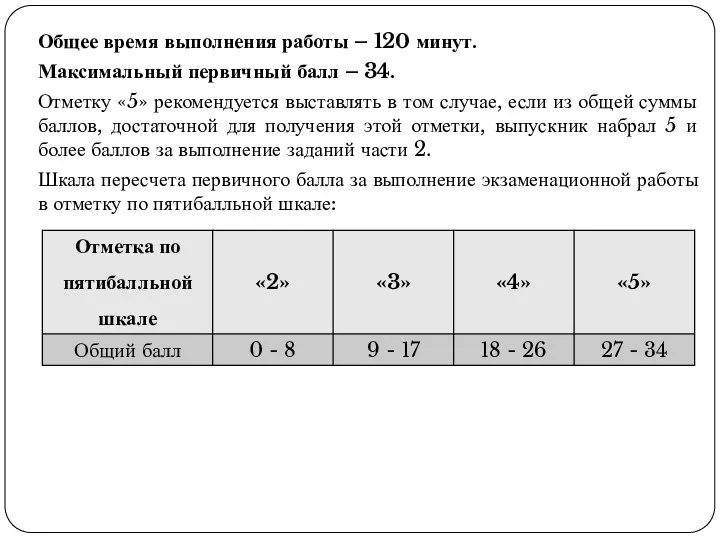
Общее время выполнения работы – 120 минут.
Максимальный первичный балл – 34.
Отметку
«5» рекомендуется выставлять в том случае, если из общей суммы баллов, достаточной для получения этой отметки, выпускник набрал 5 и более баллов за выполнение заданий части 2.
Шкала пересчета первичного балла за выполнение экзаменационной работы в отметку по пятибалльной шкале:
Слайд 7
Слайд 8

Слайд 9

10: Химические свойства оксидов: основных, амфотерных, кислотных.
Химическая реакция возможна между оксидом
углерода (IV) и
гидроксидом кальция
соляной кислотой
оксидом кремния
кислородом
Слайд 10

10: Химические свойства оксидов: основных, амфотерных, кислотных.
Химическая реакция возможна между
оксидом
фосфора (V) и гидроксидом калия
оксидом алюминия и водой
оксидом кремния и соляной кислотой
оксидом цинка и кислородом
Слайд 11

11: Химические свойства оснований. Химические свойства кислот.
Раствор гидроксида кальция не реагирует
с
карбонатом калия
оксидом железа (II)
оксидом фосфора (V)
хлороводородом
Слайд 12

11: Химические свойства оснований. Химические свойства кислот.
В результате взаимодействия гидроксида меди
(II) с соляной кислотой образуются
→ CuO +H2 + Cl2
→ CuCl2 + H2O
→ CuOH + Cl2
→ CuCl2 +H2
Слайд 13

12: Химические свойства солей (средних).
С раствором сульфата натрия реагирует
SiO2
NaOH
Cu3(PO4)2
Ba(NO3)2
Слайд 14
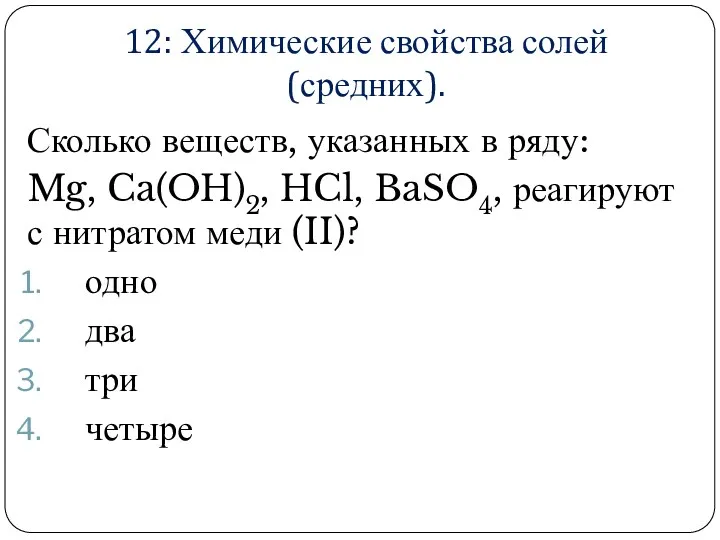
12: Химические свойства солей (средних).
Сколько веществ, указанных в ряду:
Mg, Ca(OH)2,
HCl, BaSO4, реагируют с нитратом меди (II)?
одно
два
три
четыре













 Химические свойства алканов
Химические свойства алканов Особенности сжигания жидкого топлива и топливосжигающие устройства
Особенности сжигания жидкого топлива и топливосжигающие устройства Бериллий, магний и щелочноземельные металлы
Бериллий, магний и щелочноземельные металлы Галогены
Галогены Титриметрический анализ. (Лекция 22)
Титриметрический анализ. (Лекция 22) Стратегия химической промышленности
Стратегия химической промышленности Общие черты гидротермальных месторождений
Общие черты гидротермальных месторождений Степень окисления
Степень окисления Липиды, биологическая роль, классификация
Липиды, биологическая роль, классификация Альдегиды и кетоны
Альдегиды и кетоны Кислород и озон
Кислород и озон Типы химических реакций. Опыты
Типы химических реакций. Опыты Методика изучения галогенов, галогеноводородных кислот и их солей в курсе химии средней школы
Методика изучения галогенов, галогеноводородных кислот и их солей в курсе химии средней школы Реакции нейтрализации
Реакции нейтрализации Камень чароит
Камень чароит Теория строения органических веществ А.М. Бутлерова
Теория строения органических веществ А.М. Бутлерова Азотсодержащие органические соединения
Азотсодержащие органические соединения Закон триад. Открытие периодического закона
Закон триад. Открытие периодического закона Химический состав клетки. Неорганические соединения
Химический состав клетки. Неорганические соединения Газовые смеси
Газовые смеси Бытовая химия в нашем доме и альтернативные способы уборки
Бытовая химия в нашем доме и альтернативные способы уборки Теория электролитической диссоциации
Теория электролитической диссоциации Алкалоиды и принципы их классификации
Алкалоиды и принципы их классификации Алканы. Строение, номенклатура, изомерия, химические и физические свойства
Алканы. Строение, номенклатура, изомерия, химические и физические свойства Высокомолекулярные вещества полимеры
Высокомолекулярные вещества полимеры Химические свойства толуола
Химические свойства толуола Алканы. Способы получения алканов. Химические свойства алканов
Алканы. Способы получения алканов. Химические свойства алканов Химиялық элемент алюминий
Химиялық элемент алюминий