Содержание
- 2. Вопросы: - Что общего в строении атомов ЩМ? - Как меняются восстановительные свойства ЩМ в группе?
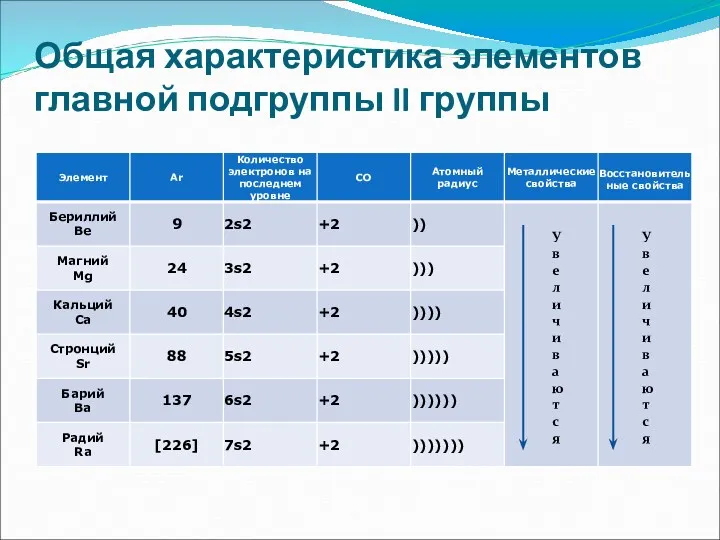
- 3. Общая характеристика элементов главной подгруппы II группы У в е л и ч и в а
- 4. Ве - амфотерный металл, Mg – металл, Сa, Sr,Ba - щёлочноземельные металлы Ra –радиоактивный элемент
- 5. Общая характеристика элементов главной подгруппы II группы Одинаковое строение внешнего электронного слоя Элементы проявляют СО +2
- 6. Be – светло-серый, твердый, хрупкий Ca – твердый, пластичный Mg – относительно мягкий, пластичный, ковкий Sr
- 8. Химические свойства элементов II группы главной подгруппы
- 9. Химические свойства оксидов BeO – амфотерный оксид MgO CaO SrO Основные оксиды BaO CaCO3 =CaO +
- 10. Взаимодействие оксида кальция с водой ( гашение извести)
- 11. Химические свойства гидроксидов Ве(ОН)2 – амфотерный гидроксид Mg(OH)2 – нерастворимое основание Ca(OH)2 Sr(OH)2 Ba(OH)2 Растворимые основания
- 12. Be(OH)2 + 2HCl = BeCl2 + 2H2O Be(OH)2 + 2NaOH = Na2BeO2 + 2H2O Ca(OH)2 +
- 15. Напишите уравнения реакций с помощью которых можно осуществить превращения: 1 вариант : Са(ОН)2 ←Са→СаО→Са(ОН)2→Са(NO3)2→CaSO4 2 вариант:
- 16. 1 вариант: Ca + 2H2O = Ca(OH)2 + H2 2Ca +O2 =2CaO CaO + H2O =
- 17. Заполните пропуски в тексте, вставив нужные слова: 1) Мел, мрамор и известняк – это минералы в
- 18. Что нового вы узнали на уроке? Чему научились? Чем урок был для вас интересен?
- 20. Скачать презентацию
















 Уксусная кислота. Продуценты. Практическое использование
Уксусная кислота. Продуценты. Практическое использование Состав краски
Состав краски Вещества молекулярного и немолекулярного строения
Вещества молекулярного и немолекулярного строения Чистые вещества и смеси
Чистые вещества и смеси Металлы применяемые в строительстве
Металлы применяемые в строительстве Железо, его характеристики, свойства и соединения
Железо, его характеристики, свойства и соединения Бензол. Физические и химические свойства
Бензол. Физические и химические свойства Растворы. Электролитическая диссоциация
Растворы. Электролитическая диссоциация Химический элемент. Неон
Химический элемент. Неон Окислительно - восстановительные реакции
Окислительно - восстановительные реакции Окислительно-восстановительные реакции. Лекция 8
Окислительно-восстановительные реакции. Лекция 8 Қанықпаған көмірсутектердің реакцияға түсу қабілеттілігі
Қанықпаған көмірсутектердің реакцияға түсу қабілеттілігі Гірські породи
Гірські породи Елементи VІ групи головної підгрупи
Елементи VІ групи головної підгрупи Хімічний зв'язок і будова речовини
Хімічний зв'язок і будова речовини Основания и кислоты. Химические и физические свойства
Основания и кислоты. Химические и физические свойства Химическая связь в кластерах
Химическая связь в кластерах Важнейшие классы бинарных соединений – оксиды и летучие соединения
Важнейшие классы бинарных соединений – оксиды и летучие соединения Атом құрылысы
Атом құрылысы Материаловедение. Железо и железоуглеродистые сплавы. (Тема 7)
Материаловедение. Железо и железоуглеродистые сплавы. (Тема 7) Бескислородные керамические материалы
Бескислородные керамические материалы Материаловедение. Физические и химические структуры материалов
Материаловедение. Физические и химические структуры материалов Carbohydrates. Starch
Carbohydrates. Starch Химическое кафе Кислоты
Химическое кафе Кислоты Хімічні властивості кисню
Хімічні властивості кисню Вода. Химические свойства воды. Состав, нахождение в природе
Вода. Химические свойства воды. Состав, нахождение в природе Медь. Химические свойства. Получение меди. Применение
Медь. Химические свойства. Получение меди. Применение Степень окисления ОВР
Степень окисления ОВР