Слайд 2

План:
Понятие, номенклатура.
Классификация оснований.
Физические и химические свойства.
Получение
Слайд 3

Основания – вещества, молекулы которых состоят из атома металла и одной
или нескольких гидроксидных групп.
Общая формула оснований: Me(OH)у
где: Ме – металл, у – число гидроксидных групп, равное валентности металла.
Большинство одно- и двухвалентных металлов образуют основания (исключения: Zn(OH)2; Be(OH)2; Sn(OH)2; Pb(OH)2).
Слайд 4
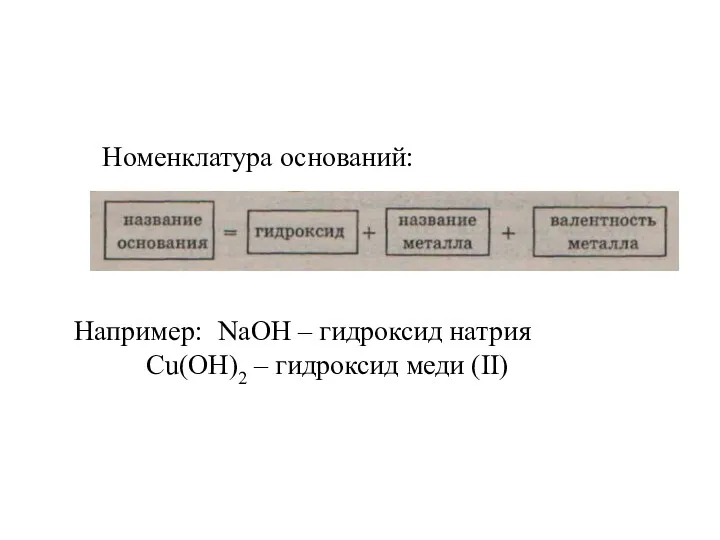
Номенклатура оснований:
Например: NaOH – гидроксид натрия
Cu(OH)2 – гидроксид меди (II)
Слайд 5

Классификация оснований
Основания можно классифицировать по двум признакам.
Слайд 6

Классификация оснований :
1. Классификация по числу гидроксидных групп в молекуле
основания.
Число гидроксидных групп – ОН в молекуле основания определяет кислотность основания.
Однокислотные основания – это основания, молекулы которых содержат одну гидроксидную группу, например: NaOH, KOH, CuOH.
Двухкислотные основания – это основания, молекулы которых содержат две гидроксидные группы, например: Ca(OH)2, Ba(OH)2, Fe(OH)2, Cu(OH)2.
Слайд 7

2. Классификация по растворимости в воде.
Есть основания растворимые и нерастворимые в
воде.
Растворимые в воде основания называются щелочами.
Щелочи образуются наиболее типичными, наиболее активными металлами. Щелочами являются: LiOH, NaOH, KOH, RbOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2.
Все другие основания являются нерастворимыми в воде. Примеры нерастворимых оснований: Cu(OH)2, Fe(OH)2.
Слайд 8

Физические свойства оснований
По агрегатному состоянию практически все основания, кроме гидроксида аммония
NH4OH, представляют собой твердые вещества разного цвета: основания, образованные щелочными и щелочноземельными металлами, являются бесцветными веществами, гидроксид меди (II) Cu(OH) – голубого цвета, гидроксид железа (III) Fe(OH) – бурого цвета и т.д.
Твердые основания не имеют запаха.
Жидкое основание NH4OH, которое образуется в результате растворения газообразного аммиака NH3 в воде, обладает запахом аммиака.
По растворимости в воде основания делятся на две группы: растворимые в воде основания и нерастворимые.
Слайд 9

Химические свойства оснований
Основания диссоциируют в водных растворах с образованием гидроксид ионов
ОН-, которые обусловливают общие химические свойства оснований:
Поэтому водные растворы щелочей изменяют окраску индикаторов.
Слайд 10

2. Основание + Кислота = Соль +H2O
Реакция между основанием и кислотой,
в результате которой образуется соль и вода, называется реакцией нейтрализации.
Например: 2NaOH + H2SO4 = Na2SO4 + H2O
Слайд 11

3. Основание + Кислотный оксид = Соль + H2O
2KOH + CO2
= K2CO3 + H2O
4. Щелочь + Соль = Соль + Нерастворимое основание
или:
Щелочь + Соль = Соль↓ + Новая щелочь
Например: 1) 2NaOH + CuSO4 = Na2SO4 + Cu(OH)2↓
2) Ba(OH)2 + Na2SO4 = BaSO4↓ + 2NaOH
Слайд 12

Растворы щелочей взаимодействуют с металлами, оксиды и гидроксиды которых амфотерны.
Ме +
Щелочь = Соль + Н2O
(водный раствор)
2Аl + 2КОН + 2Н2O = 2КAlO2 + 3Н2↑
Нерастворимые основания разлагаются.
Нерастворимое основание = Основный оксид + Н2О
Например: Сu(ОН)2 = СuО + Н2О
Слайд 13

Получение оснований
Взаимодействие щелочных и щелочноземельных
металлов с водой:
Ме + Н2О = Растворимое
основание (щелочь) + Н2↑
Взаимодействие оксидов щелочных и щелочноземельных металлов с водой:
Ме2О + Н2О = 2МеОН или МеО + Н2О = Ме(ОН)2
Слайд 14

3. Действие щелочи на растворимую соль:
Соль + Щелочь = Новая соль↓
+ Новая щелочь
Соль + Щелочь = Нерастворимое основание + Новая соль
Например: 1) 2Nа + 2Н2O = 2NаОН + Н2↑
2) Nа2О + Н2О = 2NаОН
3) Nа2SО4 + Ва(ОН)2 = ВаSО4↓ + 2NаОН
СuSO4 + 2NаОН = Сu(ОН)2↓ + Na2SO4













 Соединения водорода
Соединения водорода Химическая промышленность
Химическая промышленность Химические свойства неорганических соединений
Химические свойства неорганических соединений Алкины — углеводороды, содержащие тройную связь между атомами углерода
Алкины — углеводороды, содержащие тройную связь между атомами углерода Арены. Бензол
Арены. Бензол Практическая работа №2. Наблюдение за горящей свечой
Практическая работа №2. Наблюдение за горящей свечой Флотационные реагенты. Активаторы
Флотационные реагенты. Активаторы Основания. Химические свойства оснований. Сильные и слабые основания
Основания. Химические свойства оснований. Сильные и слабые основания Получение, собирание и распознавание газов. Практическая работа
Получение, собирание и распознавание газов. Практическая работа Сапалық талдау. Сапалық аналитикалық реакциялар
Сапалық талдау. Сапалық аналитикалық реакциялар Окислительно-восстановительные процессы
Окислительно-восстановительные процессы Химическая посуда
Химическая посуда Количество вещества. Молярная масса. Молярный объем
Количество вещества. Молярная масса. Молярный объем Производство серной кислоты
Производство серной кислоты Химические свойста воды
Химические свойста воды Масса и формулы. Химия 8 класс
Масса и формулы. Химия 8 класс Гидросульфит натрия (пищевая добавка Е222)
Гидросульфит натрия (пищевая добавка Е222) Гетерофункциональные производные бензольного ряда как лекарственные средства. Гетероциклические соединения. Алкалоиды
Гетерофункциональные производные бензольного ряда как лекарственные средства. Гетероциклические соединения. Алкалоиды Бром. Общие сведения
Бром. Общие сведения Эко-упаковка
Эко-упаковка Проект Получение пресной и чистой воды
Проект Получение пресной и чистой воды Строение атома
Строение атома Непредельные углеводороды. Алкены
Непредельные углеводороды. Алкены Изомерия. (11 класс)
Изомерия. (11 класс) Оксиды. Номенклатура, классификация, физические свойства
Оксиды. Номенклатура, классификация, физические свойства Алмазы. Бриллианты
Алмазы. Бриллианты Использование горюче-смазочных материалов в автотранспорте
Использование горюче-смазочных материалов в автотранспорте Химический потенциал. Фазовые равновесия
Химический потенциал. Фазовые равновесия