Содержание
- 2. Гомологический ряд. Изомерия алкенов. Номенклатура алкенов. Строение алкенов. Физические свойства алкенов. Химические свойства алкенов. Получение алкенов.
- 3. Алкены Алкены – непредельные углеводороды, в молекулах которых содержится одна двойная связь между атомами углерода. CnH2n
- 4. Гомологический ряд алкенов CnH2n Гомологи – имеют сходное строение и свойства, но отличающиеся на одну или
- 5. Изомерия алкенов 1) углеродного скелета CH2 = CH – CH2 – CH3 CH2 = C –
- 6. Изомерия алкенов 4) пространственная (цис-транс-изомерия) CH3 H H H \ / \ / C = C
- 7. Правила построения названий алкенов по систематической международной номенклатуре ИЮПАК Выбрать самую длинную цепь атомов углерода, содержащую
- 8. СH3 CH2 C CH CH2 СH3 СH3 Выбираем главную углеродную цепь, она обязатель- но должна содержать
- 9. 4- этилоктен -2 СН3- СН2- СН - СН=СН2 СН3 СН3- СН= СН - СН - СН2
- 10. Основное состояние возбужденное состояние атома углерода атома углерода Строение алкенов В гибридизации участвуют орбитали одного s-
- 11. Строение алкенов Образование π-связи У каждого атома С есть ещё по одному облаку, которые в гибридизации
- 12. Этилен – газ, почти без запаха, плохо растворим в воде. Строение этилена С2Н4 – молекулярная формула
- 13. Физические свойства алкенов Физические свойства алкенов закономерно изменяются в гомологическом ряду: от С2Н4 до С4Н8 –
- 14. II. Реакции окисления III. Реакции замещения IV. Реакции изомеризации Гидрирование Галогенирование Гидрогалогенирование Гидратация Полимеризация Горение Окисление
- 15. Этиленовые углеводороды обладают большей химической активностью, чем предельные углеводороды. Потому что активность зависит от строения, -
- 16. Реакции присоединения Гидрирование Гидратация Химические свойства алкенов С2Н4 + НОН → С2Н5ОН этиловый спирт (этанол)
- 17. Галогенирование Гидрогалогенирование n CH2 = CH2 → (- CH2 – CH2 -)n ЭТИЛЕН ПОЛИЭТИЛЕН Химические свойства
- 18. Реакции окисления Горение C2 H4 + 3O2 → 2CO2 + 2H2O + Q Частичное окисление Химические
- 19. Качественные реакции на алкены Окисление перманганатом калия в нейтральной среде (р. Вагнера) H2C=CH2 + [О] +
- 20. H2C=CH2 + Br2 → BrCH2–CH2Br С2Н4 + Br2 → С2Н4Br2 дибромэтан Качественные реакции на алкены
- 21. Получение алкенов В лаборатории Из этилового спирта (дегидратация)* С2Н5ОН → С2Н4 + Н2О Отщепление галогенводородов из
- 22. В промышленности Крекинг алканов Дегидрирование алканов Получение алкенов
- 23. Анестезирующие средства Моющие средства Синтетические волокна Средства для ускорения созревания овощей и фруктов (–CH2–CH2–) Пластмасса Синтетический
- 24. 1 2 3 4 5 6 а) СН3─С═СН─СН2─СН─СН3 СН3 СН3 1 4 5 6 б) Н3С
- 25. а) СН3-СН=СН2 + НСl → ? б) СН2=СН-СН2-СН3 + НBr → ? В) СН3-СН2-СН=СН2 + НОН
- 27. Скачать презентацию
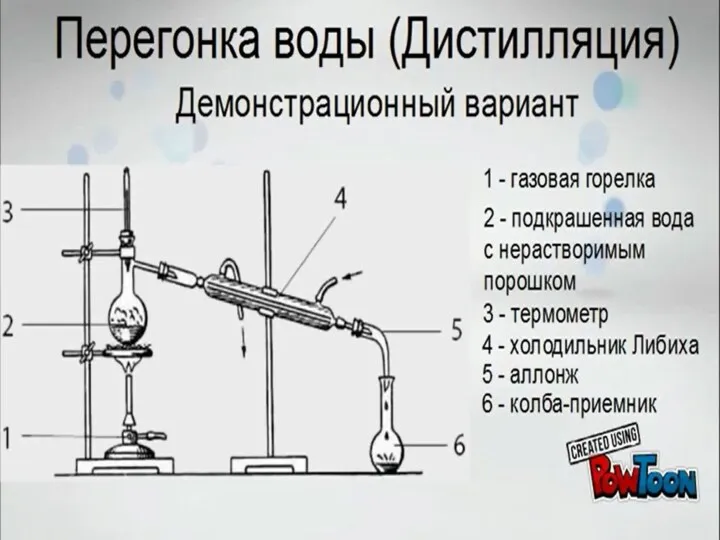 Перегонка воды (дистилляция). Демонстрационный вариант
Перегонка воды (дистилляция). Демонстрационный вариант Химия элементов VA группы (пниктогены или пникти́ды)
Химия элементов VA группы (пниктогены или пникти́ды) Реакции ионного обмена
Реакции ионного обмена Растворы. Термодинамика процесса растворения. Способы выражения концентрации. Идеальные растворы. Законы Рауля
Растворы. Термодинамика процесса растворения. Способы выражения концентрации. Идеальные растворы. Законы Рауля Основні поняття матеріального балансу. Розрахунок об’єму повітря та продуктів згоряння при горінні речовин та матеріалів
Основні поняття матеріального балансу. Розрахунок об’єму повітря та продуктів згоряння при горінні речовин та матеріалів Волшебница - вода
Волшебница - вода Геохимия литосферы
Геохимия литосферы Железо и его соединения
Железо и его соединения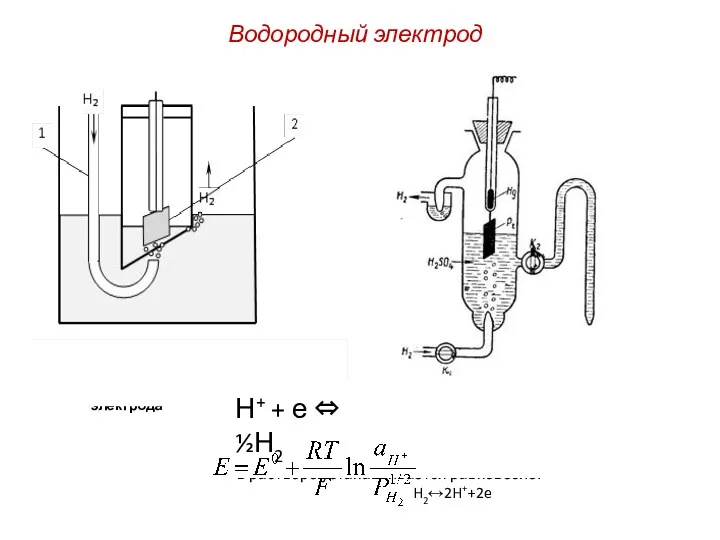 Водородный электрод
Водородный электрод Биохимическая трансформация веществ (2)
Биохимическая трансформация веществ (2) Создание пилотной производства 500 тонн в год рафинированного металлургического кремния Si 99,99% для нужд солнечной энергетики
Создание пилотной производства 500 тонн в год рафинированного металлургического кремния Si 99,99% для нужд солнечной энергетики Углерод
Углерод Фазовые превращения в стали при охлаждении
Фазовые превращения в стали при охлаждении Обмоточные провода
Обмоточные провода Альдегиды и кетоны
Альдегиды и кетоны Растворы. Способы выражения концентраций растворов
Растворы. Способы выражения концентраций растворов Розділ 3. Теорія комплексних сполук. Комплексні сполуки
Розділ 3. Теорія комплексних сполук. Комплексні сполуки Строение и свойства комплексных соединений
Строение и свойства комплексных соединений Химическая связь
Химическая связь Окисно-відновні реакції. Хімія. 9 клас
Окисно-відновні реакції. Хімія. 9 клас Электростатические взаимодействия, как фактор, определяющий структуру и реакционную способность органических соединений
Электростатические взаимодействия, как фактор, определяющий структуру и реакционную способность органических соединений Общая характеристика липидов. Строение. Классификация. Функции. Переваривание и всасывание липидов в ЖКТ Роль желчи
Общая характеристика липидов. Строение. Классификация. Функции. Переваривание и всасывание липидов в ЖКТ Роль желчи Алюміній: загальна характеристика, властивості , добування, застосування. Алюміній оксид, алюміній гідроксид, їх амфотерність
Алюміній: загальна характеристика, властивості , добування, застосування. Алюміній оксид, алюміній гідроксид, їх амфотерність М.В.Ломоносов о пользе стекла
М.В.Ломоносов о пользе стекла Электролитическая диссоциация
Электролитическая диссоциация Получение и свойства азота
Получение и свойства азота Молярный объем газов. 8 класс
Молярный объем газов. 8 класс Сложные эфиры. Жиры
Сложные эфиры. Жиры