Содержание
- 2. Основные определения Раствор – это термодинамически устойчивая гомогенная система, состоящая из 2-х и более компонентов. Растворителем
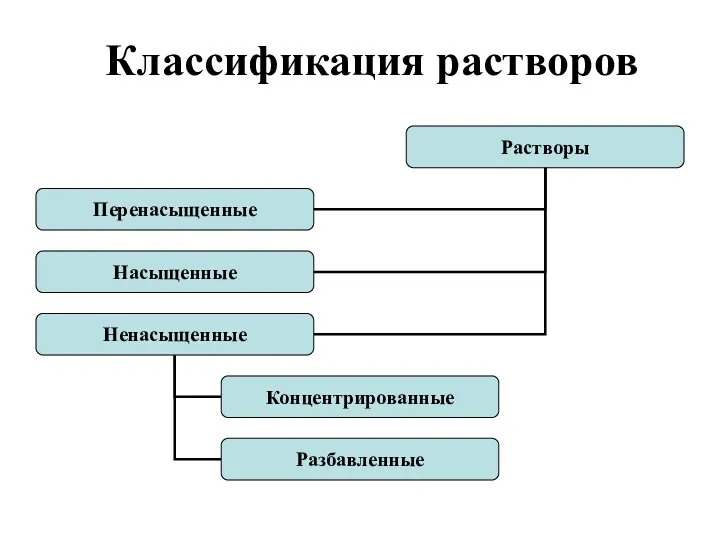
- 3. Классификация растворов
- 4. Способы выражения количественного состава растворов Массовая доля — отношение массы растворённого вещества к массе раствора. где:
- 5. Молярная концентрация — количество растворённого вещества (число молей) в единице объёма раствора. где: ν — количество
- 6. Нормальная концентрация — количество эквивалентов данного вещества в 1 литре раствора, моль-экв/л. Сн = m/Э∙V Где:
- 7. Теория электролитической диссоциации
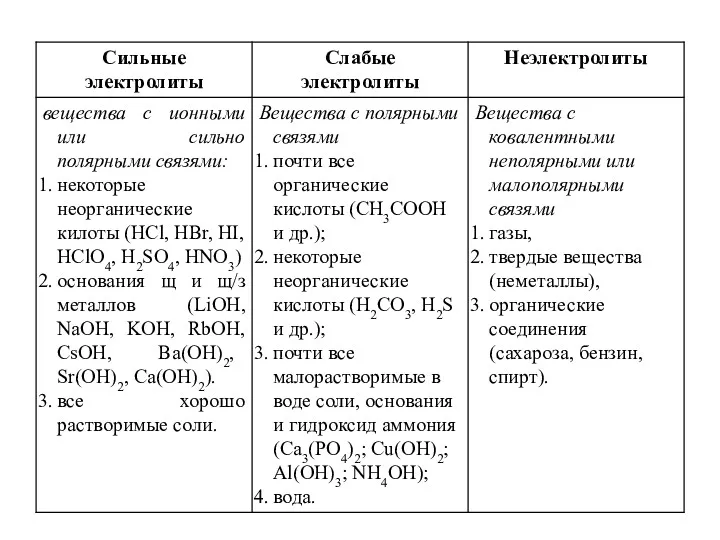
- 8. Основные положения теории электролитической диссоциации (С. Аррениус, 1887г. ) 1. При растворении в воде (или расплавлении)
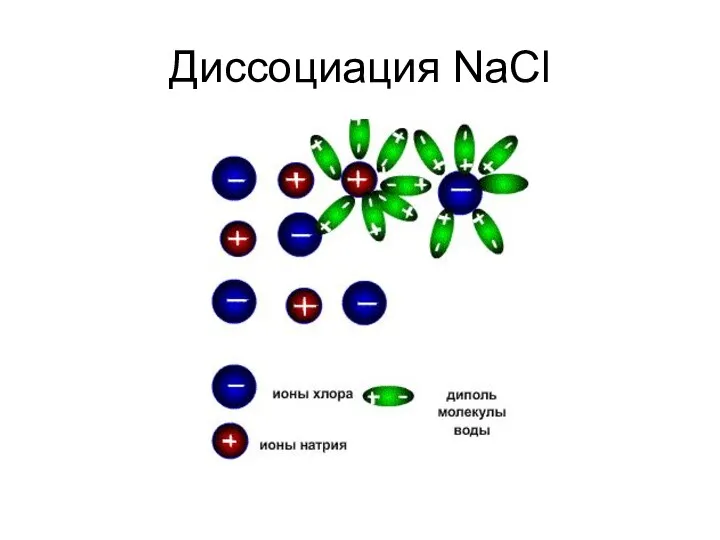
- 9. Диссоциация NaCl
- 14. Количественная характеристика диссоциации Степень электролитической диссоциации (a) - отношение числа молекул, распавшихся на ионы (n) к
- 15. Диссоциация воды. Водородный показатель среды рН. В чистой воде [H+] = [OH-] pH=7 В кислых растворах
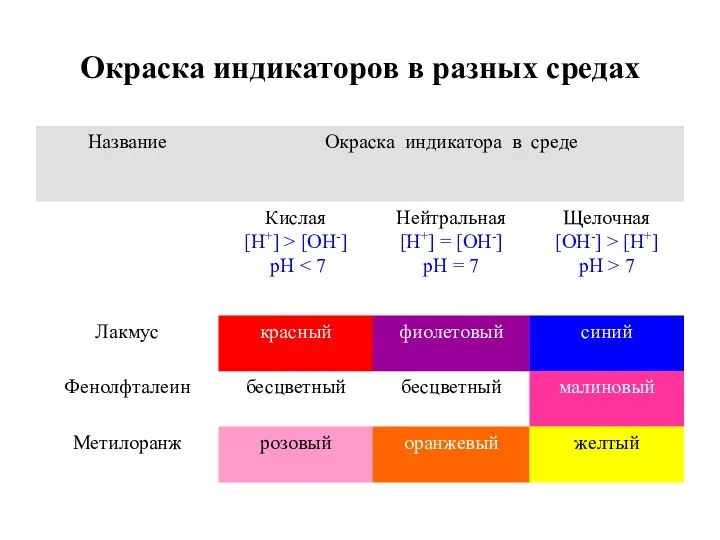
- 16. Окраска индикаторов в разных средах
- 18. Жесткость воды
- 19. Понятие и виды жесткости Жесткость – свойство воды, обусловленное содержанием большого количества солей кальция и магния.
- 20. Расчет жесткости воды Ж= m·1000/Э∙V Где Ж – жесткость воды, мг-экв/л; m – масса соли, содержащей
- 21. Последствия использования жесткой воды Плохие органолептические свойства воды Большой расход мыла при стирке. Преждевременный износ тканей
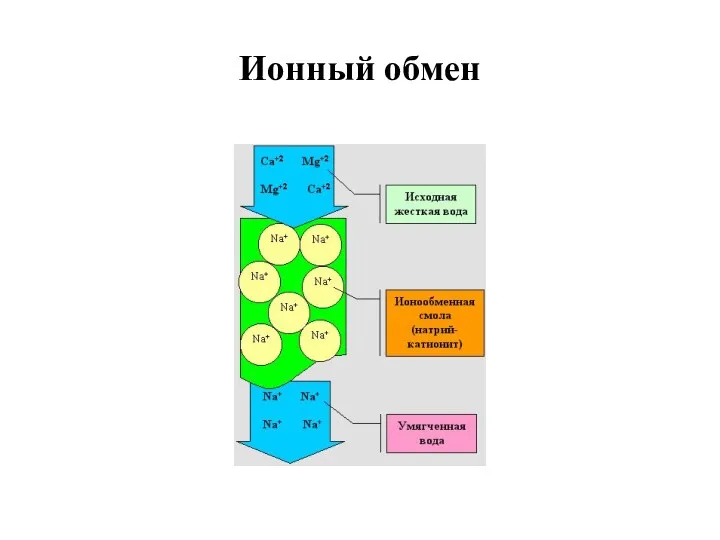
- 23. Устранение жесткости - умягчение реагентные методы; ионообменные методы; термическое умягчение; комбинированные методы (реагентные + ионный обмен;
- 25. Ионный обмен
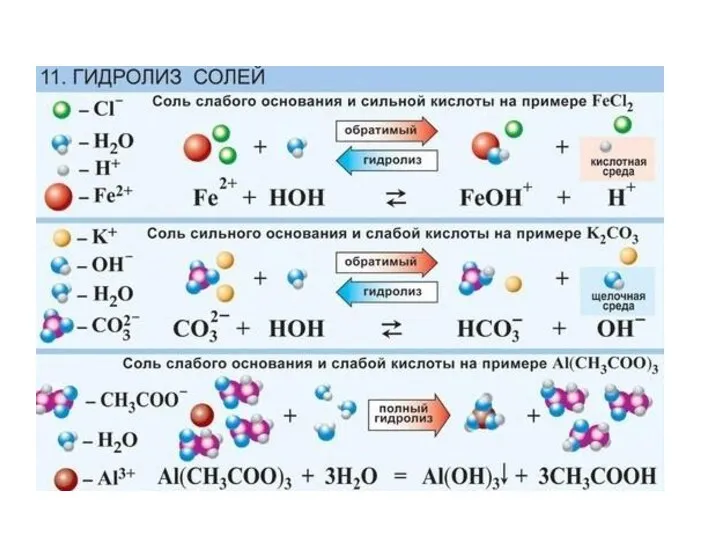
- 26. Гидролиз солей
- 27. Гидролиз – это взаимодействие вещества с водой, приводящее к образованию слабого электролита. Виды гидролиза солей: гидролиз
- 30. Скачать презентацию










![Диссоциация воды. Водородный показатель среды рН. В чистой воде [H+]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/288786/slide-14.jpg)










 Общая характеристика углеводов: глюкоза
Общая характеристика углеводов: глюкоза Основания, их классификация и свойства в свете теории электролитической диссоциации
Основания, их классификация и свойства в свете теории электролитической диссоциации Закон сохранения массы веществ
Закон сохранения массы веществ Обобщающий урок по теме Металлы
Обобщающий урок по теме Металлы Методы определения поверхностной энергии твердых тел. Контроль растекания, смачивания, адгезии и водостойкости покрытий
Методы определения поверхностной энергии твердых тел. Контроль растекания, смачивания, адгезии и водостойкости покрытий Основное уравнение молекулярно-кинетической теории. Идеальный газ
Основное уравнение молекулярно-кинетической теории. Идеальный газ Күкірт қышқылы
Күкірт қышқылы Интересные факты о химических веществах
Интересные факты о химических веществах Химическая термодинамика
Химическая термодинамика Введение в кристаллографию
Введение в кристаллографию Оксиды. Химические свойства и получение оксидов
Оксиды. Химические свойства и получение оксидов Химиялық тепе-теңдік және оның ығысуына әсер етуші жағдайлар. Ле Шателье-Браун принциптері
Химиялық тепе-теңдік және оның ығысуына әсер етуші жағдайлар. Ле Шателье-Браун принциптері Приемы обращения с лабораторным оборудованием. Строение пламени
Приемы обращения с лабораторным оборудованием. Строение пламени Пластмасса, пластикалық материалдар
Пластмасса, пластикалық материалдар Предмет и задачи химии. Место химии среди естественных наук. Атомно-молекулярное учение. Основные стехиометрические законы химии
Предмет и задачи химии. Место химии среди естественных наук. Атомно-молекулярное учение. Основные стехиометрические законы химии Использование сплавов алюминия
Использование сплавов алюминия Щелочные металлы
Щелочные металлы Липиды. Составные части липидов
Липиды. Составные части липидов Кислородсодержащие органические соединения. 9 класс
Кислородсодержащие органические соединения. 9 класс Химия и повседневная жизнь человека
Химия и повседневная жизнь человека Йони. Йонний зв’язок, його утворення
Йони. Йонний зв’язок, його утворення Пластмассы, синтетические каучуки
Пластмассы, синтетические каучуки Електронні і графічні електронні формули атомів s-, p-, d- елементів. Принцип Мінімальної енергії
Електронні і графічні електронні формули атомів s-, p-, d- елементів. Принцип Мінімальної енергії Вводная лекция
Вводная лекция Вещества и их превращения Роль химии в нашей жизни
Вещества и их превращения Роль химии в нашей жизни Stirring in liquid media
Stirring in liquid media Молекулы и атомы. Броуновское движение
Молекулы и атомы. Броуновское движение соединения VI группы продвинутая версия
соединения VI группы продвинутая версия