Предмет и задачи химии. Место химии среди естественных наук. Атомно-молекулярное учение. Основные стехиометрические законы химии презентация
Содержание
- 2. Химия. Предмет и задачи химии Место химии среди естественных наук М.В. Ломоносов: «Химическая наука рассматривает свойства
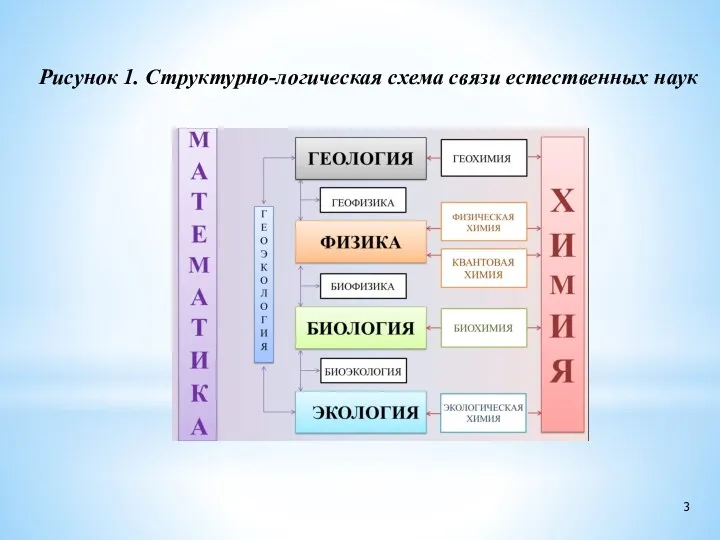
- 3. Рисунок 1. Структурно-логическая схема связи естественных наук 3
- 4. Материя, весь материальный мир во всем разнообразии его существования и преобразований – предмет изучения физики, химии,
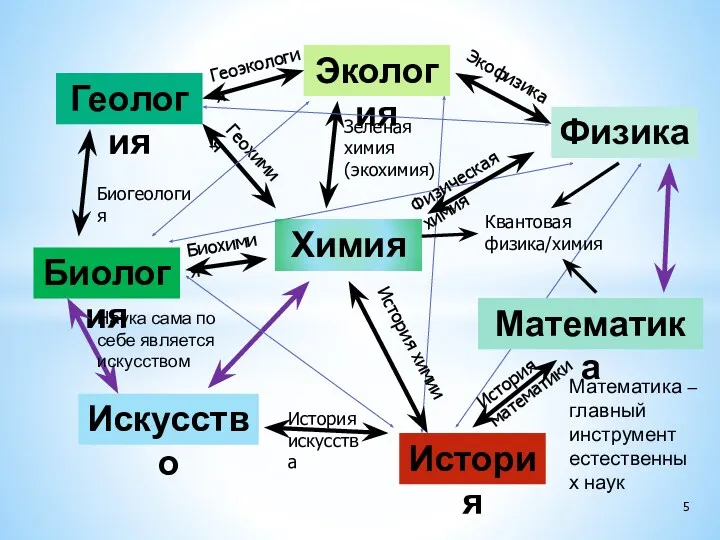
- 5. Химия Физика Биология История Математика Искусство Геология Экология Зеленая химия (экохимия) Геохимия История химии Биохимия Геоэкология
- 6. Научная картина мира – это целостная система представлений об общих свойствах и закономерностях природы. Самостоятельные разделы
- 7. Роль химии в промышленности и сельском хозяйстве: Древние ремесла: получение металлов, стекла, керамики, красителей. Современная промышленность.
- 8. Применение химических методов, например, катализа (ускорение процессов), химической обработки металлов, защиты металлов от коррозии во многих
- 9. Формируемые общепрофессиональные компетенции* (ОПК) и планируемые результаты обучения по дисциплине * Компетенция – это а) знания,
- 10. Основная литература М.И. Гельфман, В.П. Юстратов. Неорганическая химия : Учеб. для вузов / 2-е изд., стер.
- 11. Химия – это наука о составе, строении и свойствах веществ, их превращениях и тех явлениях, которыми
- 12. АТОМНО-МОЛЕКУЛЯРНОЕ УЧЕНИЕ (АМУ) ОСНОВНЫЕ СТЕХИОМЕТРИЧЕСКИЕ ЗАКОНЫ ХИМИИ
- 13. 1. Введение 2. Атомно-молекулярное учение (АМУ) в химии 3. Основные понятия: атом, молекула, атомная и молекулярная
- 14. Первое определение химии как науки: «Химическая наука рассматривает свойства и изменение тел, …объясняет причину того, что
- 15. ОСНОВНЫЕ ЭТАПЫ РАЗВИТИЯ ХИМИИ Предалхимический период: до III в. н.э. Алхимический период: III – XVI вв.
- 16. Макет химической лаборатории М. В. Ломоносова 16
- 17. Все вещества состоят из «корпускул» (молекул), между которыми имеются промежутки. Молекулы находятся в непрерывном, самопроизвольном движении.
- 18. Ученые, внесшие вклад в развитие АМУ: А.-Л. Лавуазье (опыты по определению изменения массы веществ при прокаливании,
- 19. Молекула – наименьшая частица вещества, способная к самостоятельному существованию, обладающая его химическими свойствами и состоящая из
- 20. Простые вещества образуются при соединении друг с другом атомов одного и того же элемента Примеры: Н2,
- 21. ЭЛЕМЕНТ, ПРОСТОЕ ВЕЩЕСТВО, СЛОЖНОЕ ВЕЩЕСТВО Элемент, S 21
- 22. ЭЛЕМЕНТ, ПРОСТОЕ ВЕЩЕСТВО, СЛОЖНОЕ ВЕЩЕСТВО Элемент, Cu 22
- 23. ОСНОВНЫЕ СТЕХИОМЕТРИЧЕСКИЕ ЗАКОНЫ ХИМИИ Стехиометрия – раздел химии, в котором рассматриваются количественные (массовые, объемные, мольные) соотношения
- 24. ЗАКОН СОХРАНЕНИЯ МАССЫ И ЭНЕРГИИ Сформулирован 16 июля 1748 года Михаилом Васильевичем Ломоносовым: «Все перемены, в
- 25. ЗАКОН СОХРАНЕНИЯ МАССЫ И ЭНЕРГИИ Связь между массой и энергией: E = mс2 В изолированной системе
- 26. ЗАКОН ПОСТОЯНСТВА СОСТАВА Сформулирован в 1806 году Жозефом Луи Прустом «От одного полюса Земли до другого
- 27. Джон Дальтон (1766 – 1844) Клод Луи Бертолле (1748 – 1822) Соединения постоянного состава называются дальтонидами
- 28. ЗАКОН ПОСТОЯНСТВА СОСТАВА Каждое индивидуальное чистое вещество молекулярного строения имеет постоянный состав молекул независимо от способа
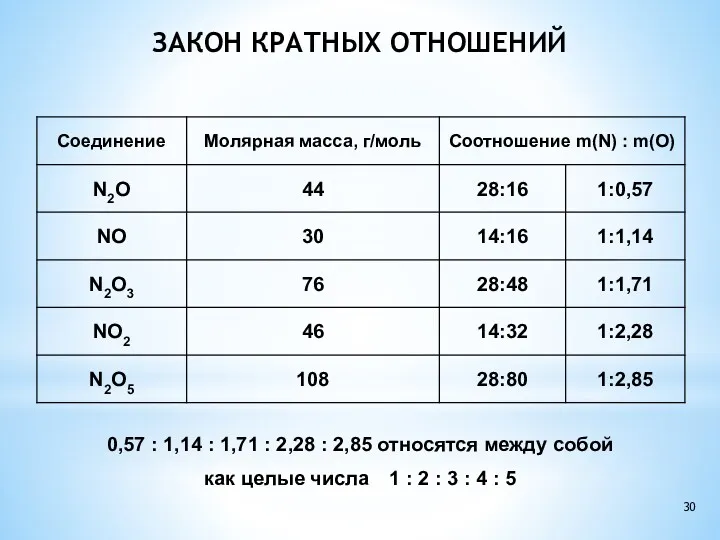
- 29. ЗАКОН КРАТНЫХ ОТНОШЕНИЙ Джон Дальтон (1766 – 1844) Сформулирован в 1803 году Джоном Дальтоном: Если два
- 30. ЗАКОН КРАТНЫХ ОТНОШЕНИЙ 0,57 : 1,14 : 1,71 : 2,28 : 2,85 относятся между собой как
- 31. Эквивалент (Э) – это реальная (атом, молекула, ион) или условная (доля атома, молекулы, иона) частица элемента
- 32. Эквивалент химического соединения – это реальная или условная частица этого сложного вещества, которая полностью взаимодействует с
- 33. ЗАКОН ЭКВИВАЛЕНТОВ Сформулирован Иеремием Вениамином Рихтером в 1793 году Массы взаимодействующих друг с другом веществ пропорциональны
- 34. ЗАКОН ОБЪЕМНЫХ ОТНОШЕНИЙ Жозеф-Луи Гей Люссак (1778-1850) Сформулирован в 1808 году Жозефом-Луи Гей Люссаком При постоянном
- 35. ЗАКОН АВОГАДРО Амедео Авогадро (1776-1856) Сформулирован в 1811 году Амедео Авогадро В равных объемах различных газов
- 36. ЗАКОН АВОГАДРО Следствие 2: При постоянных давлении и температуре абсолютная плотность газа ρ равна: Следствие 4:
- 37. Отношение массы определенного объема (V) одного газа к массе такого же объема (V) другого газа, взятого
- 38. ЗАКОН БОЙЛЯ - МАРИОТТА Роберт Бойль (1627–1691) Открыт Робертом Бойлем в 1660 году и независимо Эдом
- 39. ЗАКОН ГЕЙ ЛЮССАКА Жозеф-Луи Гей Люссак (1778-1850) Открыт Жозефом-Луи Гей Люссаком в 1802 году Для данной
- 40. ЗАКОН ШАРЛЯ Сформулирован в 1787 году Ж.А.С. Шарлем (1746–1823): Для данной массы газа m при постоянстве
- 41. ОБЪЕДИНЕННЫЙ ГАЗОВЫЙ ЗАКОН Дмитрий Иванович Менделеев (1834–1907) Выведен Д.И. Менделеевым и независимо Клапейроном Уравнение состояния идеального
- 43. Скачать презентацию





































 Карбоновые кислоты. Тест
Карбоновые кислоты. Тест Кремний и его соединения
Кремний и его соединения Водородная связь
Водородная связь Природные источники углеводородов, их переработка, применение и экологические проблемы
Природные источники углеводородов, их переработка, применение и экологические проблемы Металлы и их свойства. Способы получения
Металлы и их свойства. Способы получения Органическая химия. Вещества
Органическая химия. Вещества Магматизм. (Лекция 6)
Магматизм. (Лекция 6) Кислород
Кислород Спроби класифікації хімічних елементів
Спроби класифікації хімічних елементів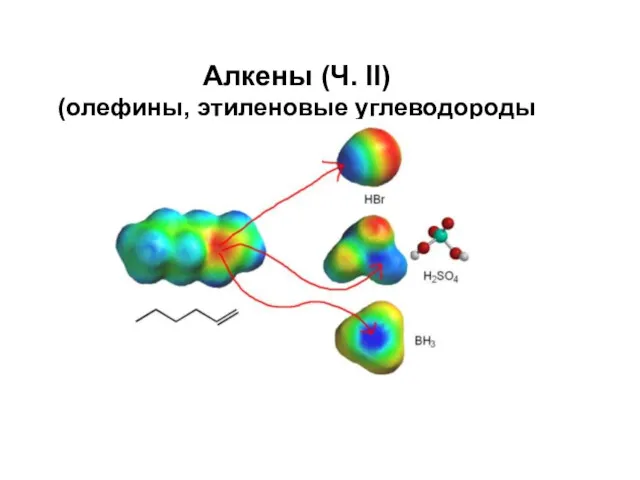 Алкены (олефины, этиленовые углеводороды)
Алкены (олефины, этиленовые углеводороды) Прочность полимеров
Прочность полимеров Амфотерные органические и неорганические соединения
Амфотерные органические и неорганические соединения Буферные растворы
Буферные растворы Місце хімії серед наук про природу
Місце хімії серед наук про природу Химические волокна
Химические волокна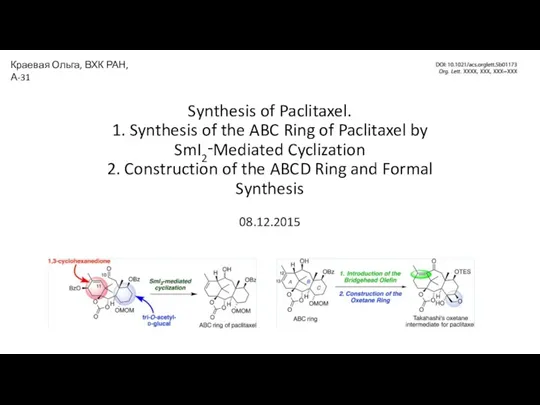 Synthesis of Paclitaxel
Synthesis of Paclitaxel Строение атома. 8 класс
Строение атома. 8 класс Лекция 3. Разновидности химических связей
Лекция 3. Разновидности химических связей Витамины. Ашылу тарихы
Витамины. Ашылу тарихы ГИА-9 Химия. А4
ГИА-9 Химия. А4 Массовая и объемная доли компонентов смеси (раствора)
Массовая и объемная доли компонентов смеси (раствора) Классификация органических соединений, углеводородов
Классификация органических соединений, углеводородов Рідкі кристали
Рідкі кристали Спирты
Спирты Химические уравнения
Химические уравнения Вещества молекулярного и немолекулярного строения
Вещества молекулярного и немолекулярного строения Применение алюминия и его сплава в машиностроении
Применение алюминия и его сплава в машиностроении Химическая связь. 8 класс
Химическая связь. 8 класс