Слайд 2

Слайд 3

Слайд 4
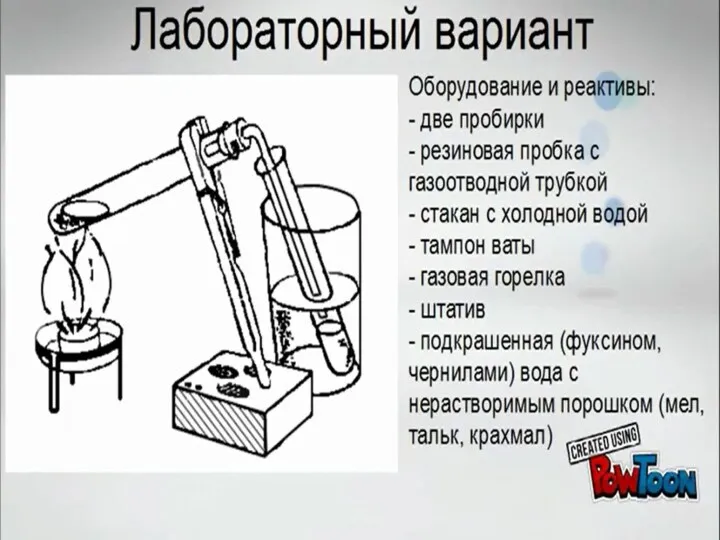
Слайд 5

Слайд 6

Слайд 7

Слайд 8

Слайд 9

Взаимодействие щелочных и щелочно-земельных металлов с водой
I. Литий
Оборудование: чашка Петри, лучинка.
Реактивы:
литий, вода, фенолфталеин.
Ход работы:
1) Наливаем в простоквашницу воду, добавив фенолфталеин
2) Достаем литий из парафина, в котором он хранится;
3) Отрезаем скальпелем маленький кусочек лития;
4) Кладем его в воду, наблюдаем , что литий «бегает» по воде, так как его толкает выделяющийся водород. Кусочек лития не плавится.
2Li+2H2O=2LiOH+H2↑
5) Лучинкой поджигаем выделяющийся газ, наблюдаем пламя ярко-красного цвета.
Слайд 10

II. Натрий
Оборудование: чашка Петри, пинцет, фильтровальная бумага.
Ход работы:
а) Приготовим дистиллированную воду и
добавим к воде фенолфталеина. Фенолфталеин изменит окраску, когда в растворе появится щелочь. Счищаем оксидную пленку и опускаем натрий в воду. Металл бурно взаимодействует с водой. Выделяется газообразный водород.
Фенолфталеин становится малиновым: в растворе образовалась щелочь - едкий натр.
2Na + 2H2O = 2NaOH + H2 ↑
б) На поверхность воды положить кусочек фильтровальной бумаги и на нее кусочек металла.
Происходит 2 процесса:
2Na + 2H2O = 2NaOH + H2 ↑
2Na + O2 = Na2O2
Na2O2 + 2H2O = 2NaOH + H2O2
H2O2 = H2O + O2 ↑
Слайд 11

III.Калий
Оборудование: стакан, воронка.
Реактивы: калий, вода, фенолфталеин.
Ход работы:
Стакан 0,5 л заполнить на
¾ водой. Положить кусочек калия на поверхность воды и сразу же закрыть воронкой. Наблюдать фиолетовое пламя горящего калия. В конце реакции всегда происходит небольшой взрыв, поэтому нельзя снимать воронку до окончания реакции. Полученный раствор испытать фенолфталеином.
2K+2H2O = 2KOH+H2↑
Слайд 12

IV.Кальций
Оборудование: фильтровальная бумага, напильник, марля, тигельные щипцы, цилиндр.
Реактивы: кальций, вода.
Ход
работы: Кальций осушить фильтровальной бумагой и зачистить напильником. Завернуть кальций в марлю. Захватить тигельными щипцами и подвести под цилиндр заполненный водой.
Са + 2Н2О = Са(ОН)2 + Н2 ↑
Слайд 13

V. Магний
Оборудование: асбестовая сетка, пробирка, держатель, плитка, колба.
Реактивы: вода, стружки магния
Ход
работы:
а) На демонстрационный стол положить асбестовую сетку, на нее насыпать горку стружек магния. Приготовить пробирку с водой, закрепленной в держателе. Стружки магния поджечь. Когда магний хорошо разгорится, полить на него водой. Наблюдать образование белых «иголок».
Mg+2H2O=Mg(OH) 2 ↓+H2↑
Слайд 14

Магний
Оборудование: асбестовая сетка, плитка, колба, ложечка.
Реактивы: вода, порошок магния
Ход работы:
б)Асбестовую
сетку положить на плитку, на нее поставить колбу с водой (плиту включить заранее, чтобы вода закипела). На ложечку поместить порошок магния, поджечь и внести в колбу. Держать ложечку над поверхностью воды, чуть касаясь воды.
Слайд 15

Магний
Оборудование: пробирка, тюльпанообразная воронка, 2 спиртовки, тарелка, штатив, картонная лопаточка.
Реактивы: речной
песок, порошок магния.
Ход работы:
в) В пробирку положить немного речного песка (1,5 см) через тюльпанообразную воронку налить воду, чтобы смочить песок, вынуть резко воронку( не намочив края). Закрепить пробирку в лапке штатива над тарелкой с песком. С помощью картонной лопаточки поместить в пробирку магний. Нагреваем магний активно, а воду слегка. Когда магний раскалится, начинаем активно нагревать воду. Образующийся водород загорается.
Mg + H2O = MgO + H2↑
Слайд 16

Слайд 17

Опыт «Примораживание стакана»
Оборудование: стакан, деревянная дощечка, стеклянная палочка.
Реактивы: вода, нитрат аммония.
Ход
работы: В тонкостенный стаканчик объемом 50 мл с плоским (не вогнутым внутрь) дном наливают 1/3 воды и ставят его на деревянную дощечку. Под дно стаканчика наливают немного воды (d капли ≈ 2,5 см), высыпают в стаканчик с налитой в него водой измельченный нитрат аммония и перемешивают стеклянной палочкой, придерживая стаканчик рукой, чтобы не сдвигать его с места.
















 Липиды, биологическая роль, классификация
Липиды, биологическая роль, классификация Альдегиды и кетоны
Альдегиды и кетоны Кислородсодержащие органические соединения- спирты. 10 класс
Кислородсодержащие органические соединения- спирты. 10 класс Ammonia and amines
Ammonia and amines Химические чистящие средства
Химические чистящие средства Пятичленные гетероциклы с одним гетероатомом
Пятичленные гетероциклы с одним гетероатомом Обчислення за хімічними рівняннями відносного виходу продукту реакції (11 клас)
Обчислення за хімічними рівняннями відносного виходу продукту реакції (11 клас) Смеси, растворы. Тест
Смеси, растворы. Тест Изотопы, их свойства и применение
Изотопы, их свойства и применение Месторождения нефрита
Месторождения нефрита Чистые вещества и смеси
Чистые вещества и смеси Основания как электролиты, их классификация по различным признакам. Химические свойства оснований
Основания как электролиты, их классификация по различным признакам. Химические свойства оснований 21. Кислоты. Определение кислот
21. Кислоты. Определение кислот Важнейшие оксиды в природе и жизни человека
Важнейшие оксиды в природе и жизни человека Выделение ферментных препаратов методами осаждения и высаливания
Выделение ферментных препаратов методами осаждения и высаливания Волокна. Классификация волокон
Волокна. Классификация волокон Химиялық элементтер
Химиялық элементтер Спирты
Спирты Литий
Литий Стоматологические материалы на основе полимеров
Стоматологические материалы на основе полимеров Основные положения теории растворов электролитов, используемых в аналитической химии
Основные положения теории растворов электролитов, используемых в аналитической химии Розрахункові задачі. Обчислення за хімічними рівняннями. Відносного виходу продукту реакції
Розрахункові задачі. Обчислення за хімічними рівняннями. Відносного виходу продукту реакції Сплавы на основе железа. Диаграмма состояния сплавов системы железо–углерод. Лекция 2. Тема 4
Сплавы на основе железа. Диаграмма состояния сплавов системы железо–углерод. Лекция 2. Тема 4 Строение вещества. Диффузия. Броуновское движение
Строение вещества. Диффузия. Броуновское движение Химиялық тепе-теңдік және оның ығысуына әсер етуші жағдайлар. Ле Шателье-Браун принциптері
Химиялық тепе-теңдік және оның ығысуына әсер етуші жағдайлар. Ле Шателье-Браун принциптері Поверхностные явления на границе раздела фаз. Хроматография, применение в медицинской практике
Поверхностные явления на границе раздела фаз. Хроматография, применение в медицинской практике Учение о растворах
Учение о растворах КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ РЕАКЦИЙ
КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ РЕАКЦИЙ