Основания как электролиты, их классификация по различным признакам. Химические свойства оснований презентация
Содержание
- 2. Основания – это сложные вещества, в состав которых входят атомы металла, связанные с одной или несколькими
- 3. Номенклатура оснований. Основания называются следующим образом: сначала произносят слово «гидроксид», а затем металл, который его образует.
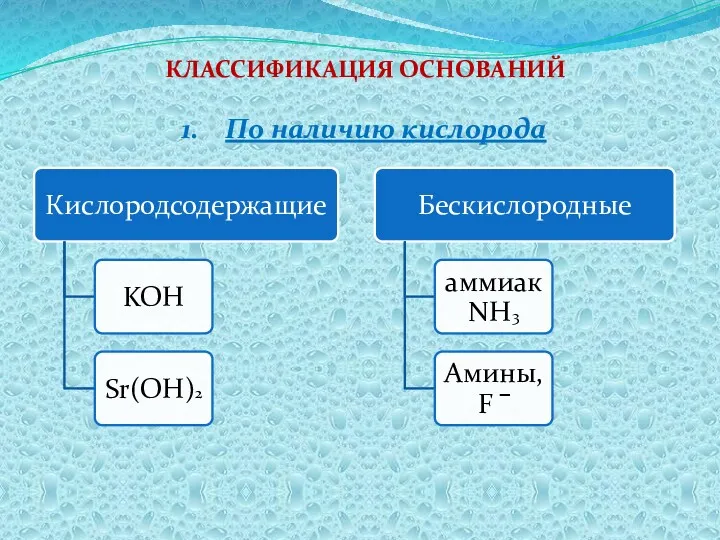
- 4. КЛАССИФИКАЦИЯ ОСНОВАНИЙ По наличию кислорода
- 5. КЛАССИФИКАЦИЯ ОСНОВАНИЙ 2. По кислотности(по числу групп ОН‾ в составе или по числу присоединяемых Н+ )
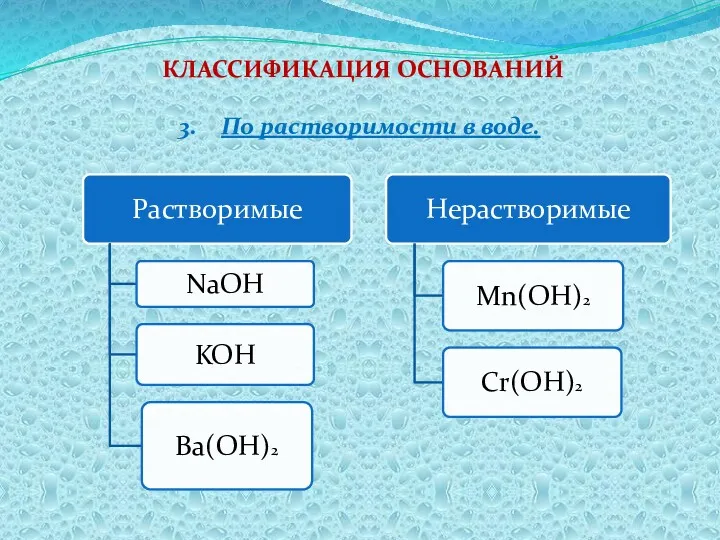
- 6. КЛАССИФИКАЦИЯ ОСНОВАНИЙ По растворимости в воде.
- 7. КЛАССИФИКАЦИЯ ОСНОВАНИЙ 4. По степени электролитической диссоциации:
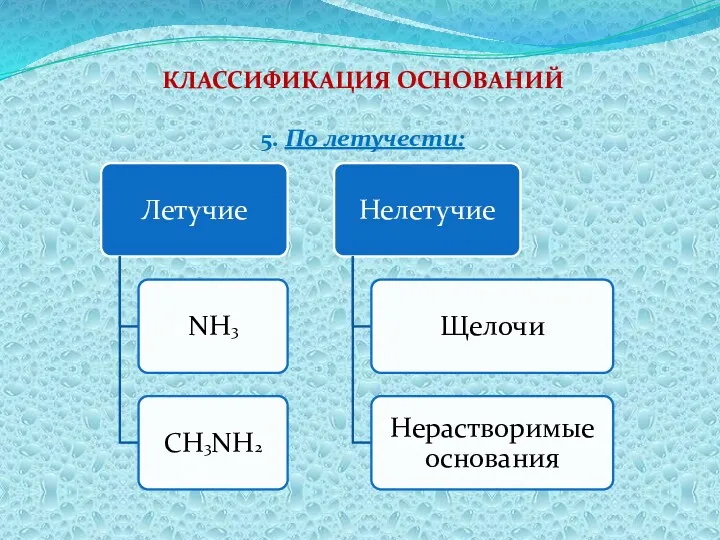
- 8. КЛАССИФИКАЦИЯ ОСНОВАНИЙ 5. По летучести:
- 9. 1. Общее уравнение электролитической диссоциации: M(OH)n = Mn+ + nOH- 2. Общие химические свойства: Водные растворы
- 10. Химические свойства оснований 3.Взаимодействие с индикаторами (щелочи окрашивают фиолетовый лакмус в синий цвет, метилоранж – в
- 11. 4.Взаимодействие оснований с кислотами: А) реакция нейтрализации между щелочью и кислотой: Ba(OH)2 + 2CH3COOH→(CH3COO)2Ba + 2H2O
- 12. Химические свойства оснований 5.Взаимодействие с кислотными оксидами: Это свойство характерно для щелочей .Например , для обнаружения
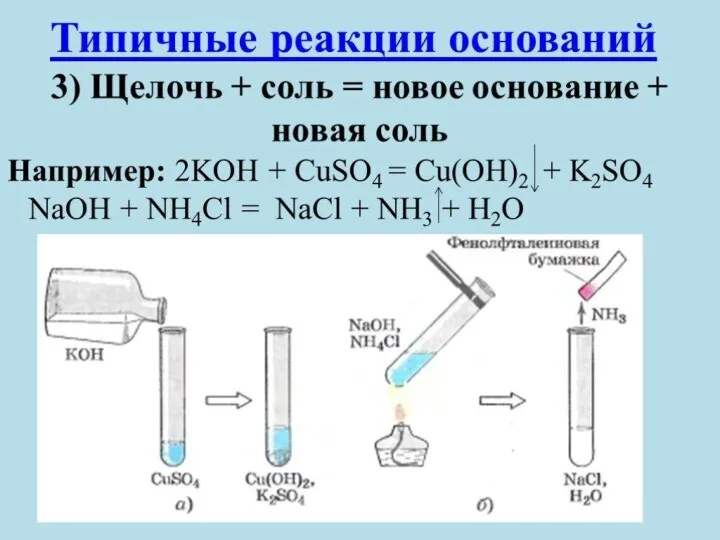
- 13. Химические свойства оснований 6. Взаимодействие с солями:
- 14. Химические свойства оснований 7 .Нерастворимые основания при нагревании разлагаются на соответствующий оксид металла и воду Cu(OH)2=CuO
- 15. Закрепление изученного материала Тест по теме «Основания» 1.Что образуется при взаимодействии раствора Ca(OH)2 и H2SO4: а)
- 16. 9. Данный гидроксид применяют в строительстве, для побелки деревьев, для получения хлорной извести а) NaOH б)
- 18. Скачать презентацию











 Строение атома и периодическая система Д.И. Менделеева
Строение атома и периодическая система Д.И. Менделеева Понятие о единичных и симметрично-равных направлениях
Понятие о единичных и симметрично-равных направлениях Углеводороды (классификация и номенклатура)
Углеводороды (классификация и номенклатура) Галогенопроизводные. Растворимость, общие закономерности
Галогенопроизводные. Растворимость, общие закономерности Химический элемент медь
Химический элемент медь Aditivii alimentari: inofensivi sau poluanţi
Aditivii alimentari: inofensivi sau poluanţi Розрахункові задачі. Розрахунки за хімічними рівняннями маси, об’єму, кількості речовини реагентів та продуктів. Хімія. 8 клас
Розрахункові задачі. Розрахунки за хімічними рівняннями маси, об’єму, кількості речовини реагентів та продуктів. Хімія. 8 клас Сполуки нітрогену з оксигеном
Сполуки нітрогену з оксигеном Атом. Химический элемент. Изотопы. Простые и сложные вещества
Атом. Химический элемент. Изотопы. Простые и сложные вещества 20230330_zakony_termodinamiki_i_kinetika
20230330_zakony_termodinamiki_i_kinetika Получение полимеров из низкомолекулярных соединений
Получение полимеров из низкомолекулярных соединений Производство ацетальдегида
Производство ацетальдегида Реакции ионного обмена
Реакции ионного обмена Кристаллография и основы кристаллохимии. Закон постоянства углов. Методы проецирования кристаллов. Лекция №6
Кристаллография и основы кристаллохимии. Закон постоянства углов. Методы проецирования кристаллов. Лекция №6 Химические процессы в атмосфере. Загрязнение атмосферы. Причины и последствия
Химические процессы в атмосфере. Загрязнение атмосферы. Причины и последствия Кремний
Кремний Главная подгруппа IV группы
Главная подгруппа IV группы Полімери. Будова і властивості полімерів
Полімери. Будова і властивості полімерів Водород. Нахождение в природе. Физические и химические свойства. Применение
Водород. Нахождение в природе. Физические и химические свойства. Применение Характеристики атома. Электроотрицательность. Шкала Полинга. Изменения химических свойств элементов в ПСЭ. (Лекция 1.2)
Характеристики атома. Электроотрицательность. Шкала Полинга. Изменения химических свойств элементов в ПСЭ. (Лекция 1.2) Арены. Бензол
Арены. Бензол Пурин нуклеозидтері (аденозии 3-фосфор қышқылы, рибоксии). Сапасына Қойылантын талаптар, талдау әдістері
Пурин нуклеозидтері (аденозии 3-фосфор қышқылы, рибоксии). Сапасына Қойылантын талаптар, талдау әдістері Металлы. Классификация металлов
Металлы. Классификация металлов Качественные реакции на функциональные группы
Качественные реакции на функциональные группы Автомобильные пластичные смазки
Автомобильные пластичные смазки Синтез на основі бензену
Синтез на основі бензену Тяжелые металлы
Тяжелые металлы Практическая работа №2. Наблюдение за горящей свечой
Практическая работа №2. Наблюдение за горящей свечой