Содержание
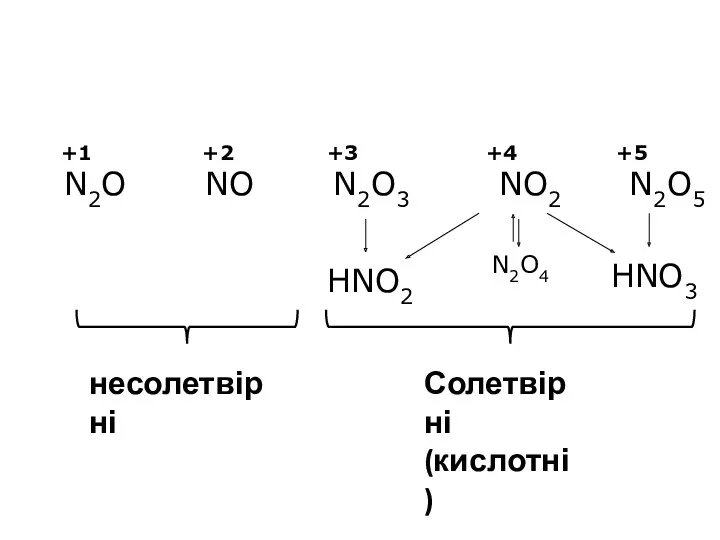
- 2. N2O NO N2O3 NO2 N2O5 +1 +2 +3 +4 +5 HNO2 HNO3 N2O4 Солетвірні (кислотні) несолетвірні
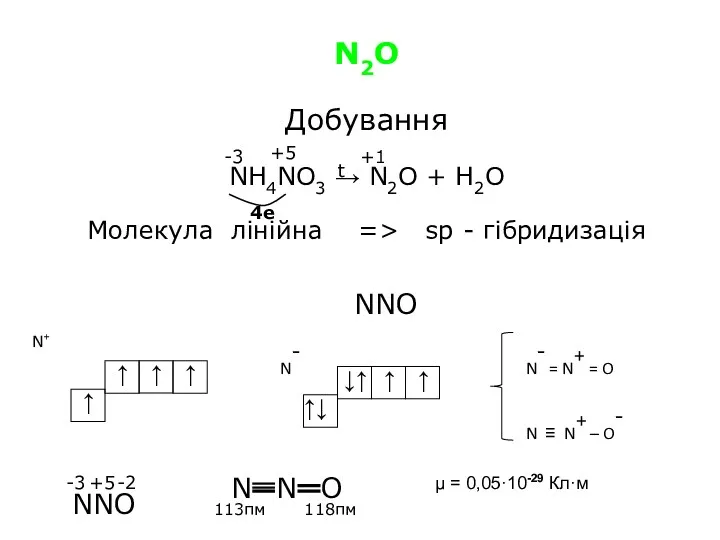
- 3. N2O Добування NH4NO3 → N2O + H2O Молекула лінійна => sp - гібридизація N- = N+
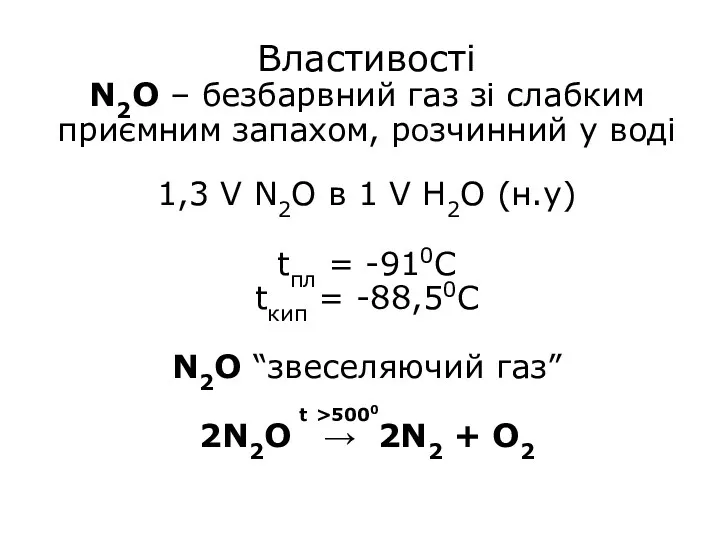
- 4. Властивості N2O – безбарвний газ зі слабким приємним запахом, розчинний у воді 1,3 V N2O в
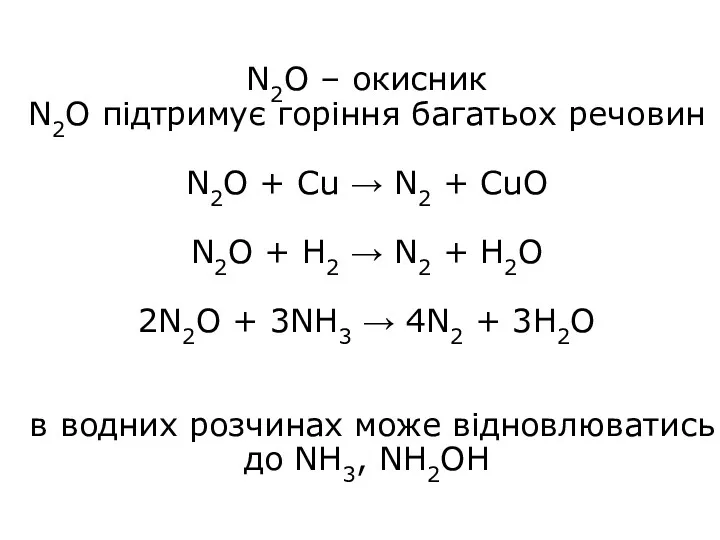
- 5. N2O – окисник N2O підтримує горіння багатьох речовин N2O + Cu → N2 + CuO N2O
- 6. NO – газ без кольору і без запаху tпл = -1640С tкип = -1510С Молекула малополярна
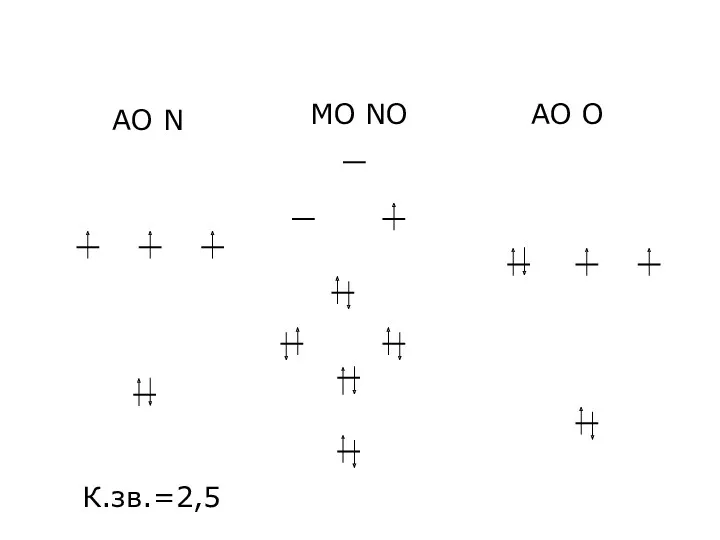
- 7. МО NO АО N AO O К.зв.=2,5
- 8. Димеризація може відбуватися за низьких температур ON· + · NO ⇆ ONNO в твердому стані 100%
- 9. В невеликих кількостях NO утворюється в атмосфері під час грозових розрядів N2 + O2 ⇆ 2NO
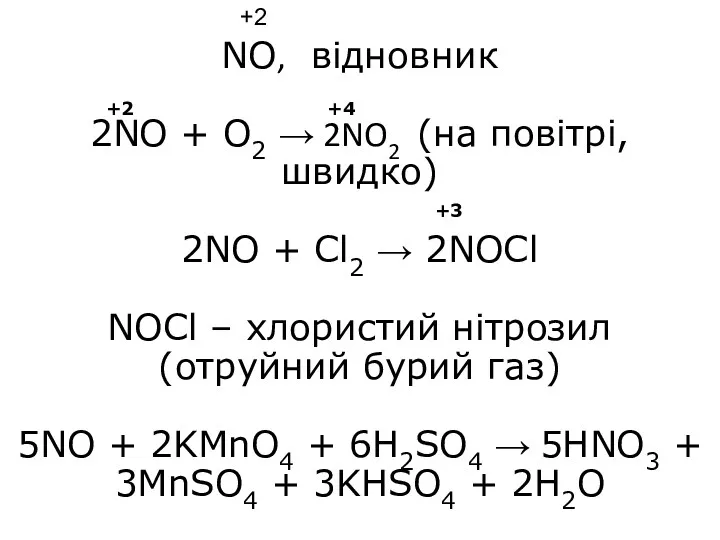
- 10. NO, відновник 2NO + O2 → 2NO2 (на повітрі, швидко) 2NO + Cl2 → 2NOCl NOCl
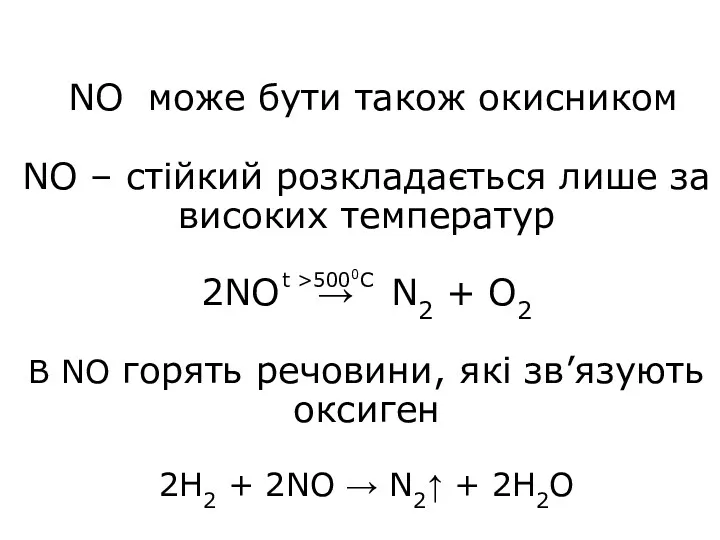
- 11. NO може бути також окисником NO – стійкий розкладається лише за високих температур 2NO → N2
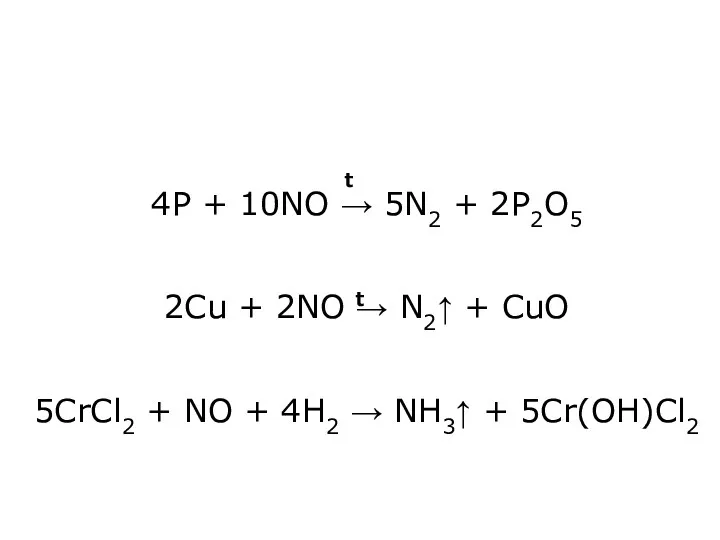
- 12. 4P + 10NO → 5N2 + 2P2O5 2Cu + 2NO → N2↑ + CuO 5CrCl2 +
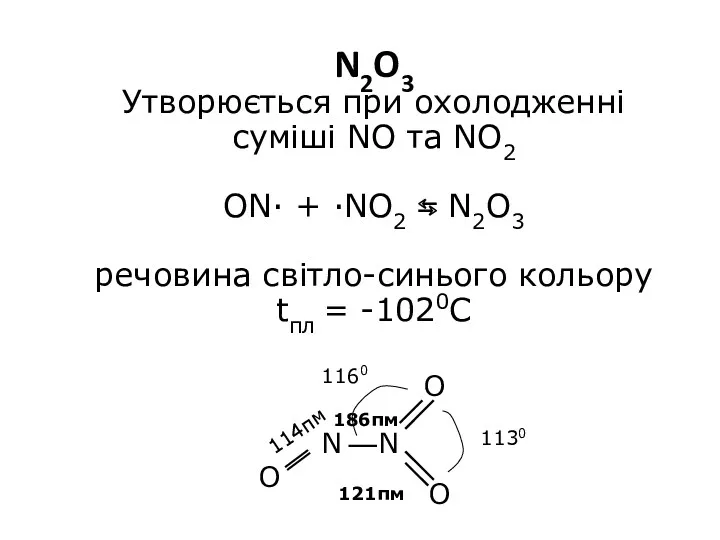
- 13. N2O3 Утворюється при охолодженні суміші NO та NO2 ON· + ·NO2 ⇆ N2O3 речовина світло-синього кольору
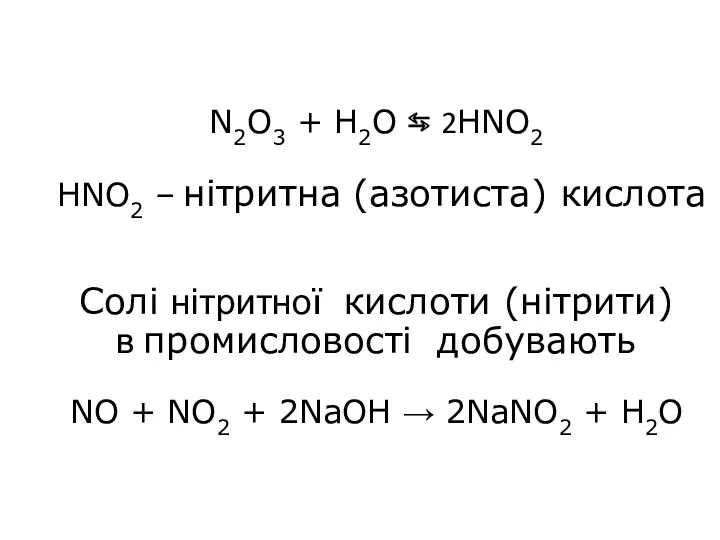
- 14. N2O3 + H2O ⇆ 2HNO2 HNO2 – нітритна (азотиста) кислота Солі нітритної кислоти (нітрити) в промисловості
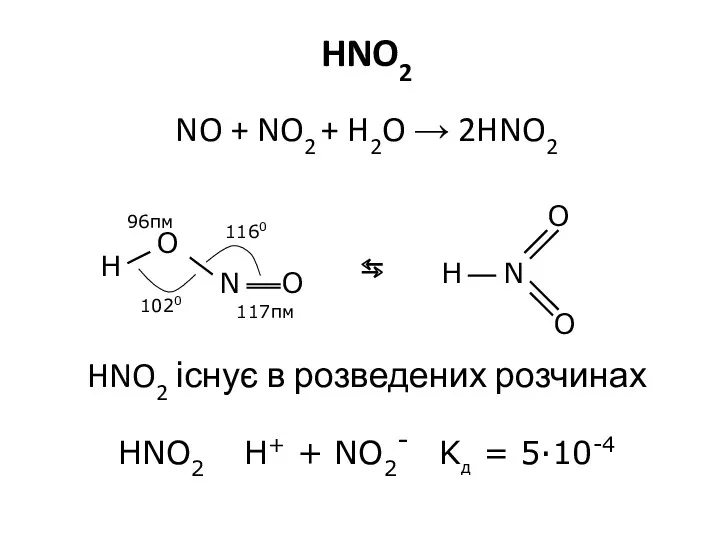
- 15. HNO2 NO + NO2 + H2O → 2HNO2 ⇆ HNO2 існує в розведених розчинах HNO2 ⇆
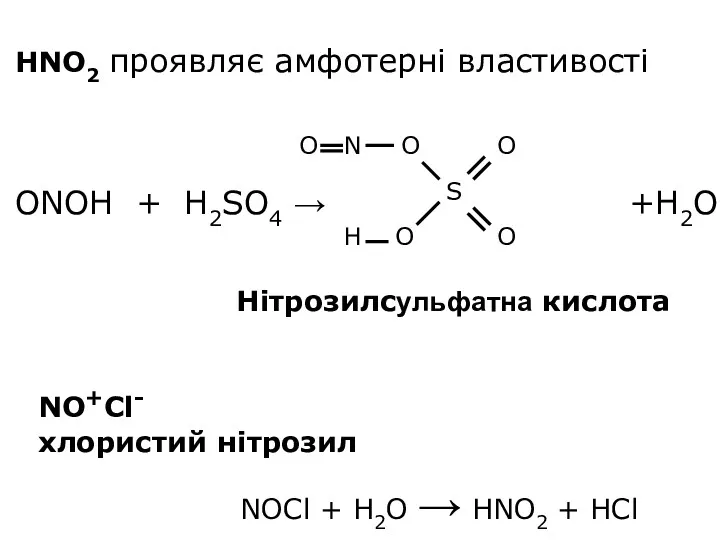
- 16. HNO2 проявляє амфотерні властивості ONOH + H2SO4 → +H2O S O O O O N H
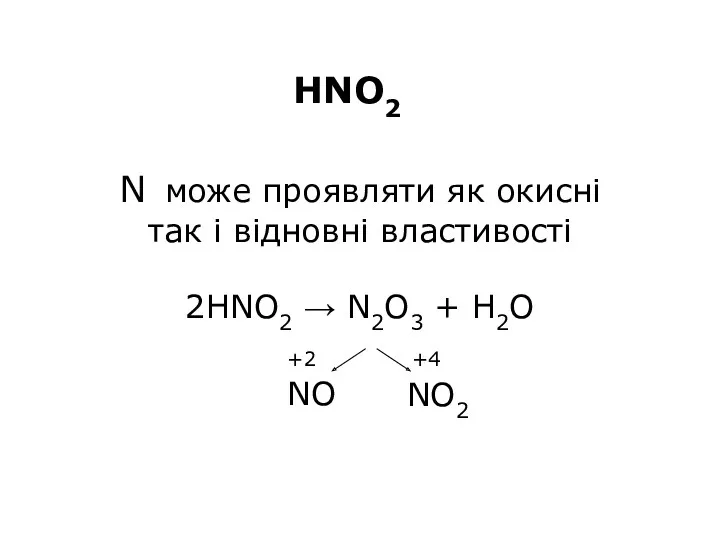
- 17. N може проявляти як окисні так і відновні властивості 2HNO2 → N2O3 + H2O +3 NO
- 18. Окисні властивості більш характерні ніж відновні HNO2 + H+ + 1e ⇆ NO + H2O E0
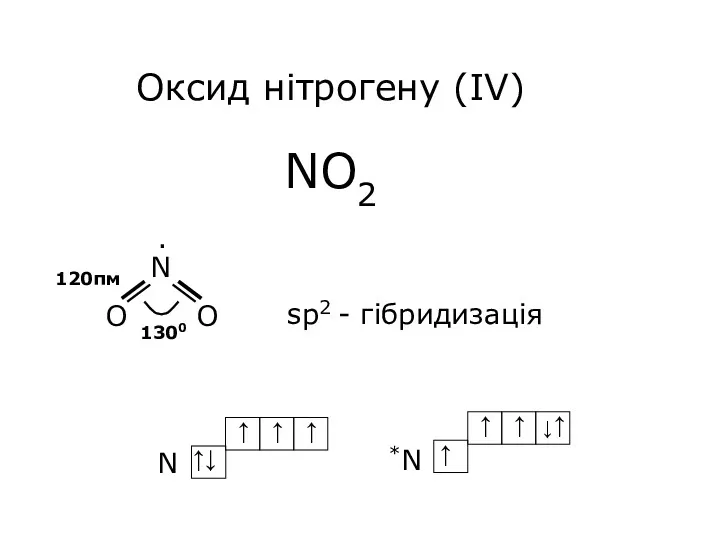
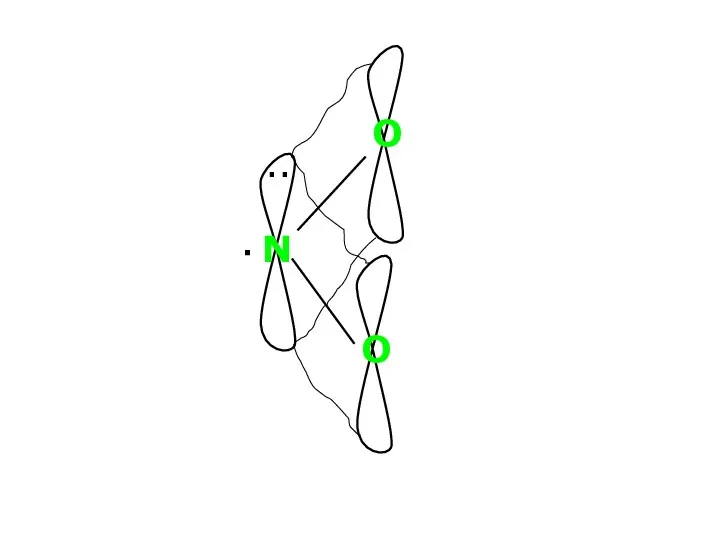
- 19. Оксид нітрогену (IV) NO2 sp2 - гібридизація 120пм ·
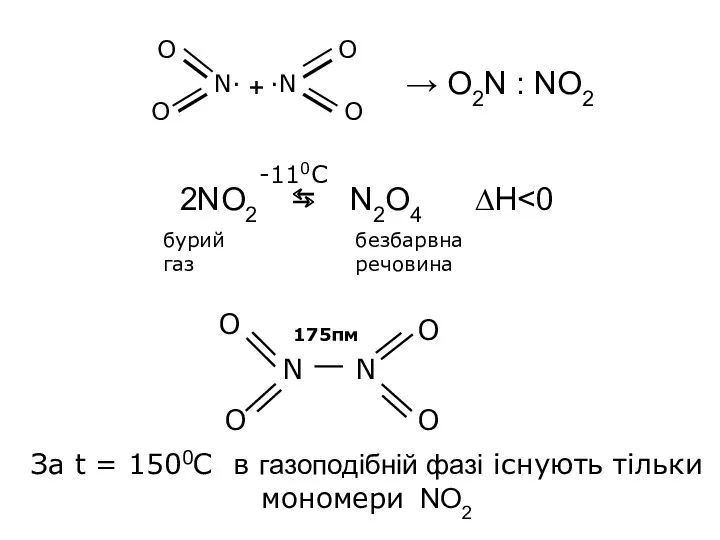
- 21. → O2N : NO2 2NO2 ⇆ N2O4 ∆H бурий газ безбарвна речовина -110С
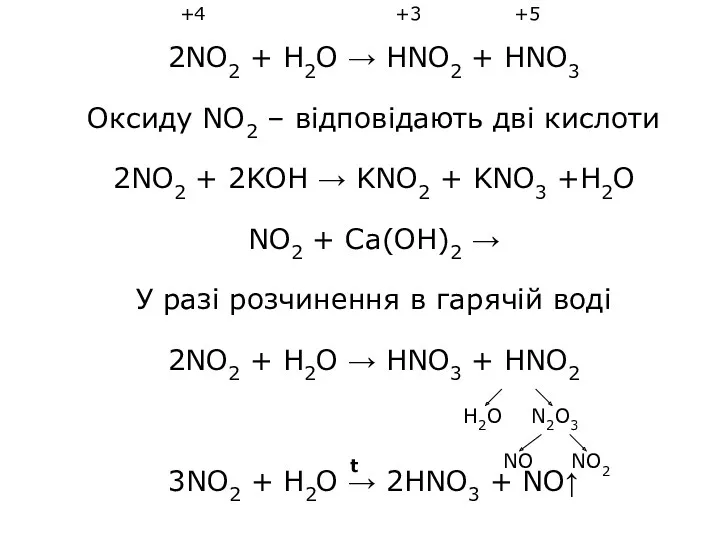
- 22. 2NO2 + H2O → HNO2 + HNO3 Оксиду NO2 – відповідають дві кислоти 2NO2 + 2KOH
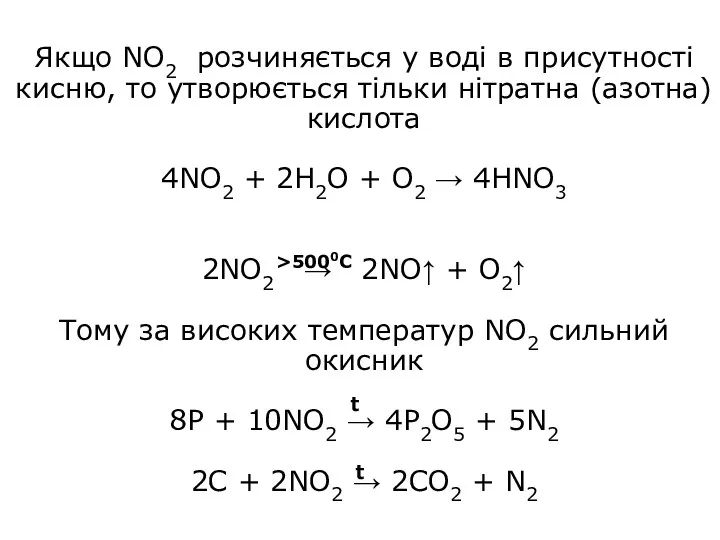
- 23. Якщо NO2 розчиняється у воді в присутності кисню, то утворюється тільки нітратна (азотна) кислота 4NO2 +
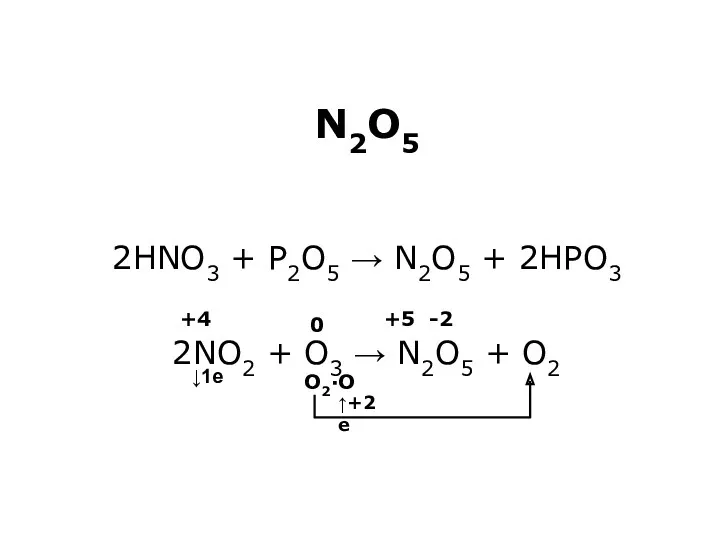
- 24. N2O5 2HNO3 + P2O5 → N2O5 + 2HPO3 2NO2 + O3 → N2O5 + O2 O2·O
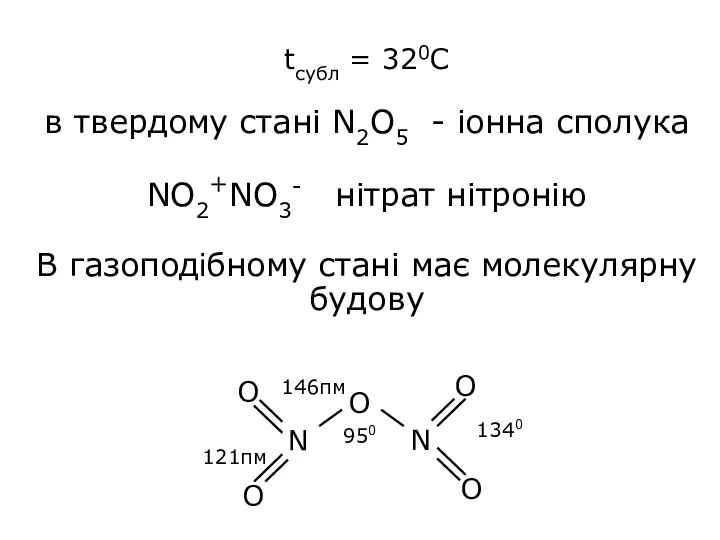
- 25. tсубл = 320С в твердому стані N2O5 - іонна сполука NO2+NO3- нітрат нітронію В газоподібному стані
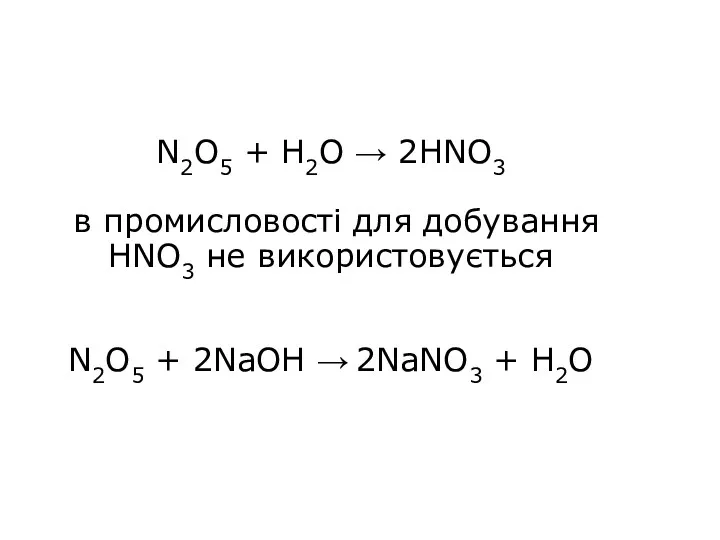
- 26. N2O5 + H2O → 2HNO3 в промисловості для добування HNO3 не використовується N2O5 + 2NaOH →
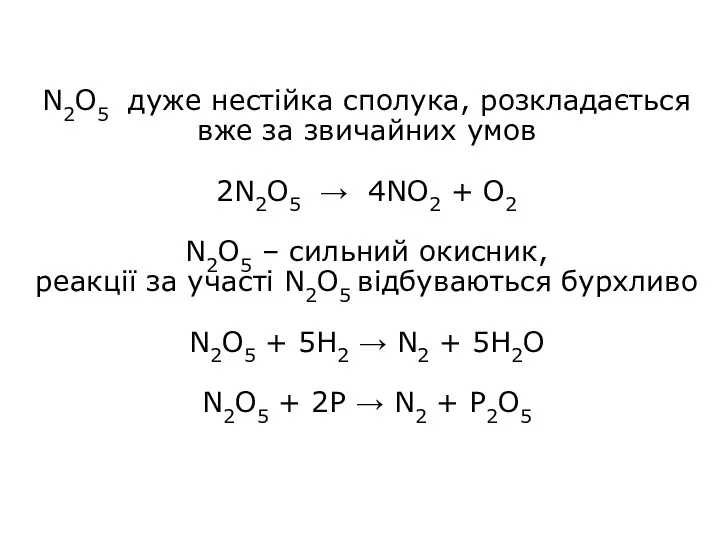
- 27. N2O5 дуже нестійка сполука, розкладається вже за звичайних умов 2N2O5 → 4NO2 + O2 N2O5 –
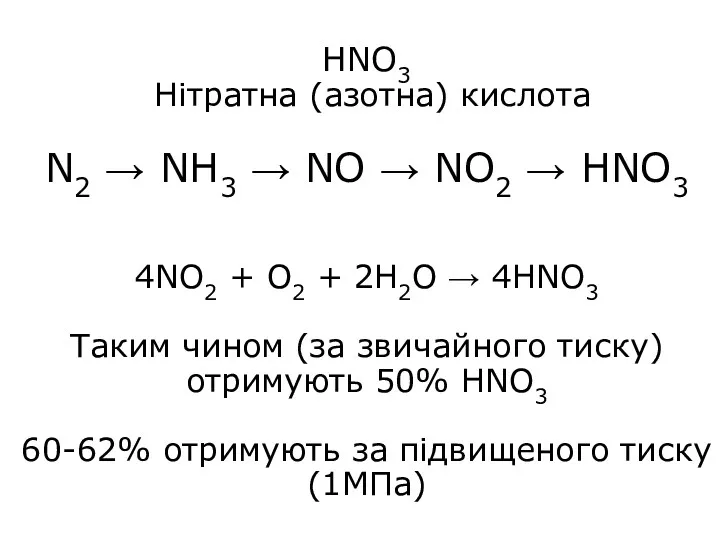
- 28. HNO3 Нітратна (азотна) кислота N2 → NH3 → NO → NO2 → HNO3 4NO2 + O2
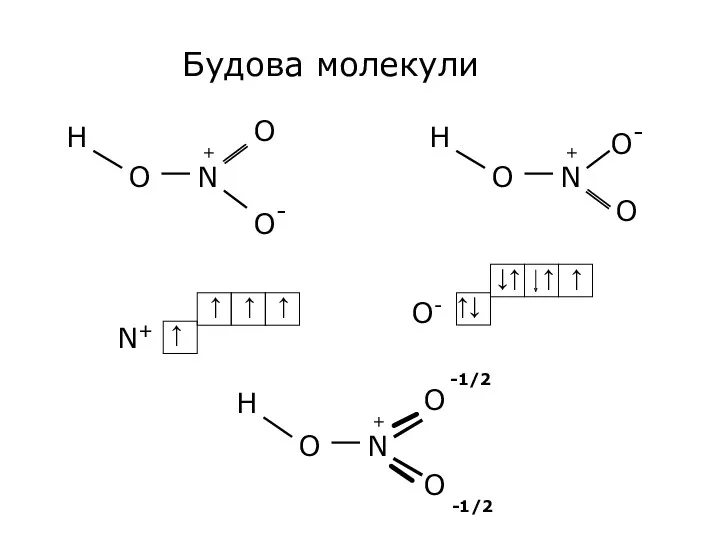
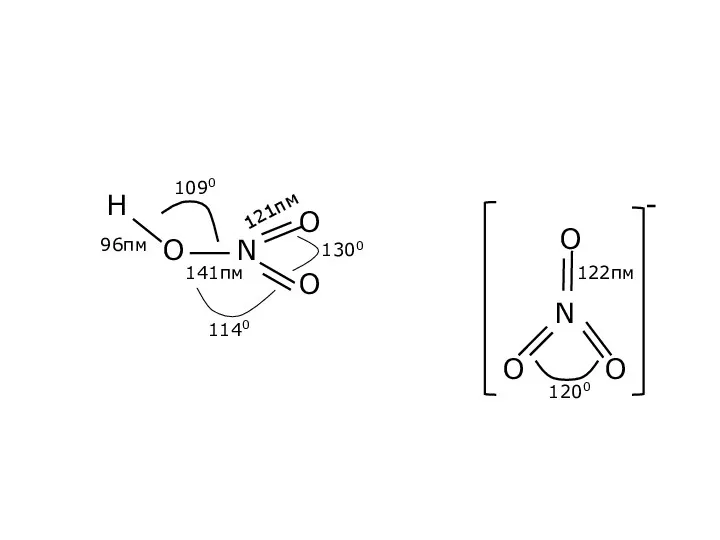
- 29. Будова молекули
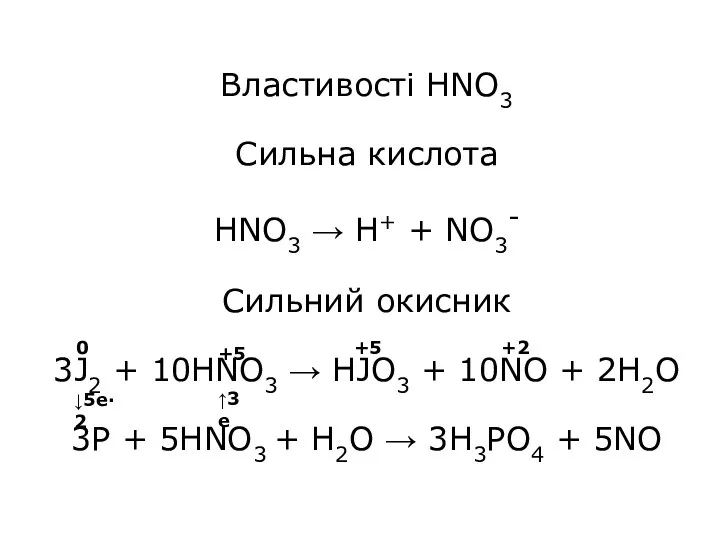
- 31. Властивості HNO3 Сильна кислота HNO3 → H+ + NO3- Cильний окисник 3J2 + 10HNO3 → HJO3
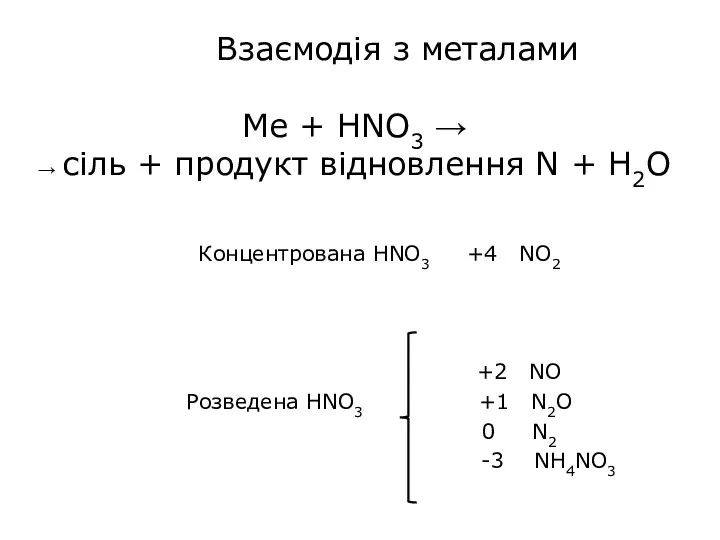
- 32. Концентрована HNO3 +4 NO2 +2 NO Розведена HNO3 +1 N2O 0 N2 -3 NH4NO3 Взаємодія з
- 33. NO3- + 1e + 2H+ ⇆ NO2 + H2O E0 = 0,80 B NO3- + 3e
- 34. Cu + HNO3(конц) → Cu(NO3)2 + NO2 + H2O Cu + HNO3(розв) → Cu(NO3)2 + NO
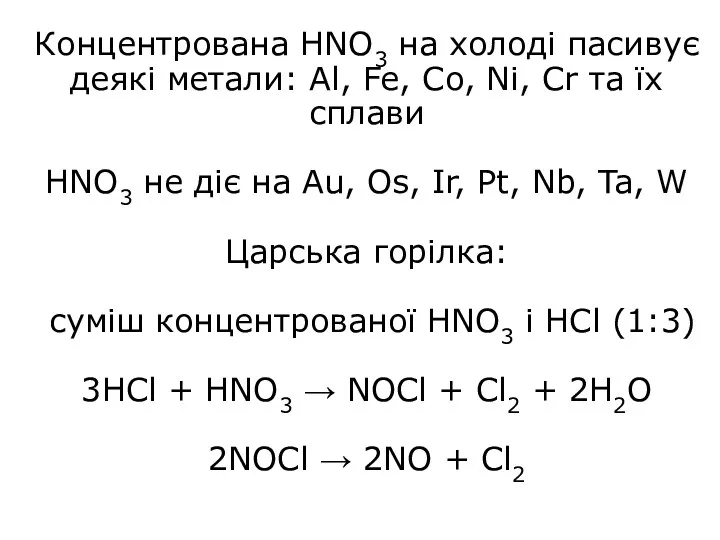
- 35. Концентрована HNO3 на холоді пасивує деякі метали: Al, Fe, Co, Ni, Cr та їх сплави HNO3
- 36. Au + HNO3 + 3HCl → AuCl3 + NO + H2O 3Pt + 4HNO3 + 18HCl
- 37. Солі нітратної кислоти Добування: взаємодія HNO3 з металами, оксидами, гідроксидами, карбонатами Всі нітрати добре розчиняються у
- 39. Скачать презентацию





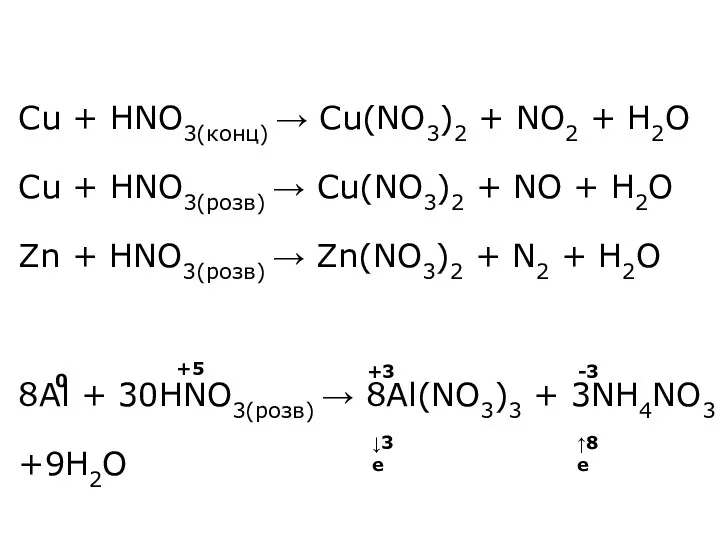
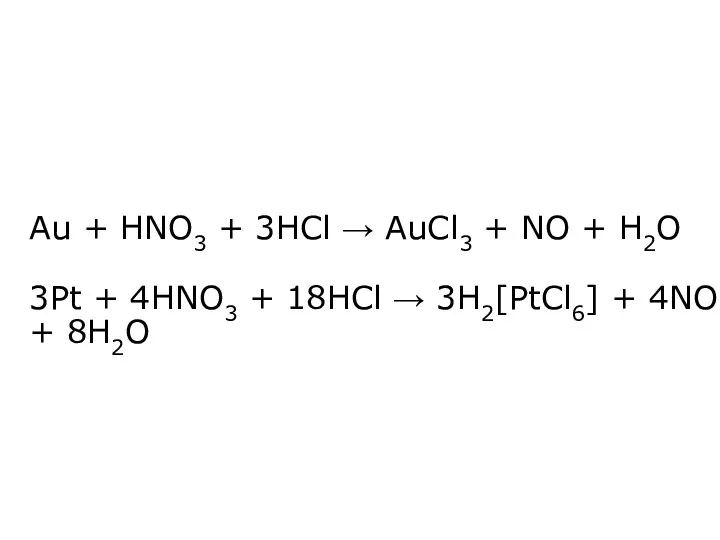

 Аррениус Сванте Август
Аррениус Сванте Август Вода как среда и участник протекания биохимических процессов в организме
Вода как среда и участник протекания биохимических процессов в организме Металлические сплавы
Металлические сплавы Гидролиз солей
Гидролиз солей Гидролиз солей
Гидролиз солей Элементы второй группы главной подгруппы
Элементы второй группы главной подгруппы Материалы с малой плотностью
Материалы с малой плотностью Строение атома
Строение атома Удобрения и их классификация
Удобрения и их классификация Основы химической термодинамики
Основы химической термодинамики Серная кислота и её свойства
Серная кислота и её свойства Новые катализаторы
Новые катализаторы яжелые металлы полезны или вредны?
яжелые металлы полезны или вредны? Паровые зоны в гидротермальных системах
Паровые зоны в гидротермальных системах Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Презентация по химии _Классификация веществ_ 11 класс
Презентация по химии _Классификация веществ_ 11 класс Процессы ацилирования
Процессы ацилирования Окисно-відновні реакції. Процеси окиснення, відновлення, окисник та відновник
Окисно-відновні реакції. Процеси окиснення, відновлення, окисник та відновник Химия и пища
Химия и пища Классификация химических реакций
Классификация химических реакций osobennosti_i_klassifikatsiya_khimicheskikh_reaktsiy_v_organicheskoy_khimii
osobennosti_i_klassifikatsiya_khimicheskikh_reaktsiy_v_organicheskoy_khimii Классы неорганических веществ (Лекция 1)
Классы неорганических веществ (Лекция 1) Топливо. Загрязнения воздуха, способы его предотвращения. Химия. 8 класс
Топливо. Загрязнения воздуха, способы его предотвращения. Химия. 8 класс Лекция 15. Аминокислоты
Лекция 15. Аминокислоты Глюкоза. Хімічні властивості глюкози. Сахароза, гідроліз
Глюкоза. Хімічні властивості глюкози. Сахароза, гідроліз Дисперсные системы
Дисперсные системы кл.химия 24.01
кл.химия 24.01 Выращивание кристаллов методом Чохральского
Выращивание кристаллов методом Чохральского