Содержание
- 2. БЕРИЛЛИЙ Be
- 3. СВОЙСТВА БЕРИЛЛИЯ -Прочность -Сопротивляемость усталости -Сопротивляемость коррозии -Сохранение упругости в значительном интервале температур -Высокая электропроводность -Высокая
- 4. СПОСОБЫ ПОЛУЧЕНИЯ БЕРИЛЛИЯ Бериллий получают электролизом расплава хлорида бериллия с добавками хлорида натрия при 300°С или
- 5. ИСПОЛЬЗОВАНИЕ БЕРИЛЛИЯ -Техника Сплав меди с бериллием или по- другому - бериллиевые бронзы. Используются чаще для
- 6. МАГНИЙ Mg
- 7. СВОЙСТВА МАГНИЯ -Легкий -Ковкий -Обладает металлическим блеском -Обладает защитной пленкой -Горит белым пламенем -Пластичен -Поддается обработке
- 8. МАГНИЙ ПОЛУЧАЮТ ЭЛЕКТРОЛИЗОМ РАСПЛАВЛЕННОГО КАРНАЛЛИТА ИЛИ ХЛОРИДА МАГНИЯ С ДОБАВКАМИ ХЛОРИДА НАТРИЯ ПРИ 720–750°С: MGCL2 MG
- 9. ИСПОЛЬЗОВАНИЕ МАГНИЯ -Военное дело Свойство магния гореть белым ослепительным пламенем широко используется в военной технике для
- 10. КАЛЬЦИЙ Ca
- 11. СВОЙСТВА КАЛЬЦИЯ -Полупроводник -Обладает металлическим блеском -Пластичен -Ковкий -Мягкий -Взаимодействует с кислотами
- 12. КАЛЬЦИЙ ПОЛУЧАЮТ ЭЛЕКТРОЛИЗОМ РАСПЛАВЛЕННОГО ХЛОРИДА КАЛЬЦИЯ С ДОБАВКАМИ ФТОРИДА КАЛЬЦИЯ: CACL2 CA + CL2 ИЛИ АЛЮМОТЕРМИЧЕСКИМ
- 13. ИСПОЛЬЗОВАНИЕ КАЛЬЦИЯ -Главное применение металлического кальция — это использование его как восстановителя при получении металлов, особенно
- 14. СТРОНЦИЙ Sr
- 15. СВОЙСТВА СТРОНЦИЯ -Мягкий -Ковкий -Пластичный -Обладает высокой температурой плавления -Обладает высокой температурой кипения -Валентость II -Взаимодействует
- 16. СТРОНЦИЙ ПОЛУЧАЮТ ЭЛЕКТРОЛИЗОМ РАСПЛАВЛЕННОГО ХЛОРИДА СТРОНЦИЯ С ДОБАВКАМИ ХЛОРИДА КАЛИЯ ПРИ 800°С: SRCL2 SR + CL2
- 17. ИСПОЛЬЗОВАНИЕ СТРОНЦИЯ -Магнитные материалы Магнитотвёрдые ферриты стронция широко употребляются в качестве материалов для производства постоянных магнитов.
- 18. БАРИЙ Ba
- 19. СВОЙСТВА БАРИЯ -Быстро окисляется -Легко воспламеняется -Обладает металлическим блеском -Твердый -Легко вступает в реакцию с галогенами
- 20. СПОСОБЫ ПОЛУЧЕНИЯ БАРИЯ Барий в основном получают методом алюмотермии: 4BaO + 2Al = 3Ba + BaAl2O4.
- 21. ИСПОЛЬЗОВАНИЕ БАРИЯ -Оптика Фторид бария применяется в виде монокристаллов в оптике (линзы, призмы) -Пиротехника Пероксид бария
- 22. РАДИЙ Ra
- 23. СВОЙСТВА РАДИЯ -Блестит -Темнеет на воздухе -Реагирует с водой -Химически активен -Степень окисления + 2 -Очень
- 24. ИСПОЛЬЗОВАНИЕ РАДИЯ -Медицина В медицине радий используют как источник радона для приготовления радоновых ванн, кратковременного облучения
- 25. ВЗАИМОДЕЙСТВИЕ С КИСЛОРОДОМ 2Ca + O = 2CaO Реакция соединения. Кальций окисляется кислородом. 2
- 26. ВЗАИМОДЕЙСТВИЕ АКТИВНЫМИ НЕМЕТАЛЛАМИ Ca + Br = CaBr Реакция соединения. 2 2
- 27. ВЗАИМОДЕЙСТВИЕ С ВОДОЙ Ca +2H O = Ca(OH) + H Реакция замещения Примечание: металлы, стоящие в
- 28. ВЗАИМОДЕЙСТВИЕ С КИСЛОТАМИ Mg + 2HCl = MgCl + H Реакция замещения. 2 2
- 30. Скачать презентацию



























 Карбоновые кислоты. Тест
Карбоновые кислоты. Тест Кремний и его соединения
Кремний и его соединения Водородная связь
Водородная связь Природные источники углеводородов, их переработка, применение и экологические проблемы
Природные источники углеводородов, их переработка, применение и экологические проблемы Металлы и их свойства. Способы получения
Металлы и их свойства. Способы получения Органическая химия. Вещества
Органическая химия. Вещества Магматизм. (Лекция 6)
Магматизм. (Лекция 6)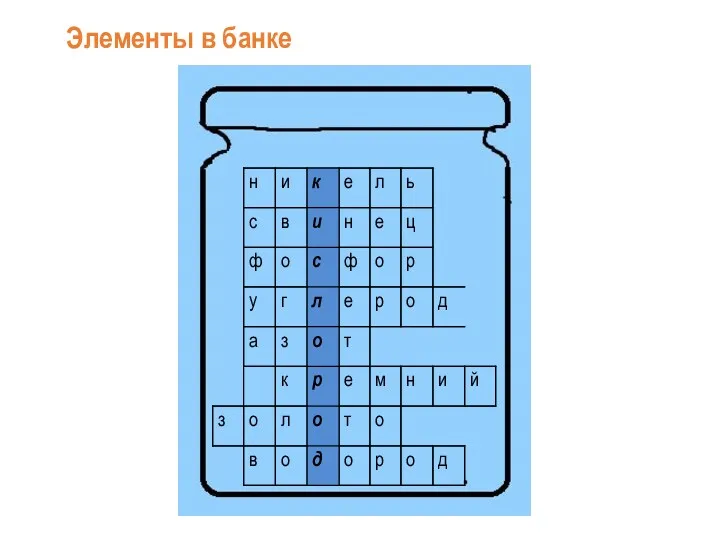 Кислород
Кислород Спроби класифікації хімічних елементів
Спроби класифікації хімічних елементів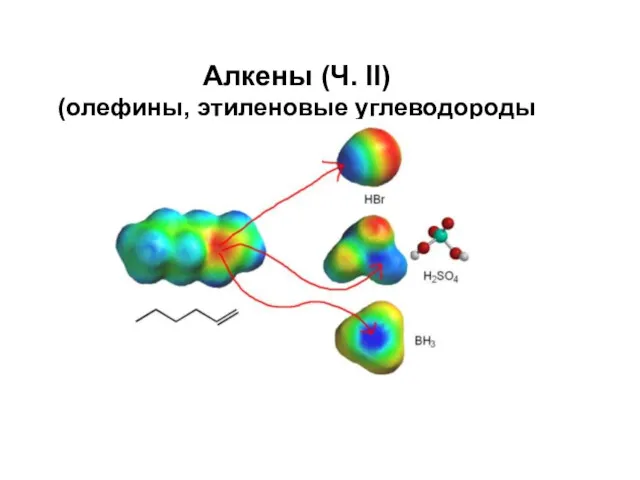 Алкены (олефины, этиленовые углеводороды)
Алкены (олефины, этиленовые углеводороды) Прочность полимеров
Прочность полимеров Амфотерные органические и неорганические соединения
Амфотерные органические и неорганические соединения Буферные растворы
Буферные растворы Місце хімії серед наук про природу
Місце хімії серед наук про природу Химические волокна
Химические волокна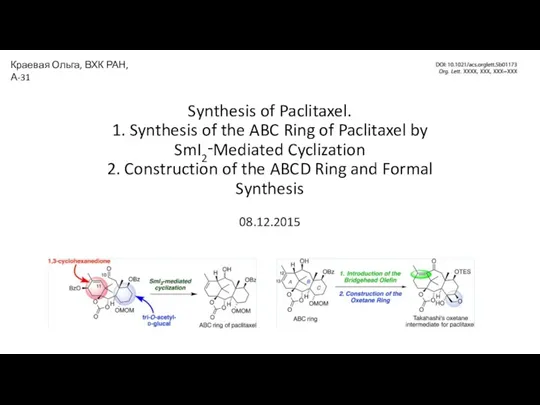 Synthesis of Paclitaxel
Synthesis of Paclitaxel Строение атома. 8 класс
Строение атома. 8 класс Лекция 3. Разновидности химических связей
Лекция 3. Разновидности химических связей Витамины. Ашылу тарихы
Витамины. Ашылу тарихы ГИА-9 Химия. А4
ГИА-9 Химия. А4 Массовая и объемная доли компонентов смеси (раствора)
Массовая и объемная доли компонентов смеси (раствора) Классификация органических соединений, углеводородов
Классификация органических соединений, углеводородов Рідкі кристали
Рідкі кристали Спирты
Спирты Химические уравнения
Химические уравнения Вещества молекулярного и немолекулярного строения
Вещества молекулярного и немолекулярного строения Применение алюминия и его сплава в машиностроении
Применение алюминия и его сплава в машиностроении Химическая связь. 8 класс
Химическая связь. 8 класс