Содержание
- 2. Содержание Общие понятия Количественные характеристики гидролиза солей Константа гидролиза Степень гидролиза Расчет степени гидролиза и рН
- 3. обменное взаимодействие в растворе ионов соли и молекул воды Н2О Н+ + ОН¯ связывание ионов соли
- 4. Типы гидролиза солей Модуль 2. Лекция 10. Гидролиз солей соль подвергается гидролизу по аниону по катиону
- 5. по аниону: HА + OH− cреда щелочная по катиону: MOH + H+ среда кислая Схема гидролиза
- 6. Константа гидролиза Гидролиз по аниону: А− + НОН НА + ОН− Константа гидролиза: Чем слабее кислота,
- 7. Константа гидролиза Гидролиз по катиону: R+ + НОН ROН + Н+ Константа гидролиза: Чем слабее основание,
- 8. Степень гидролиза соли - отношение количества вещества (соли), подвергшегося гидролизу, к общему количеству растворенного вещества Размерность
- 9. Взаимосвязь степени и константы гидролиза Соль гидролизуется по аниону: А− + НОН НА + ОН− С
- 10. Влияние природы соли слабее основание или кислота, образующие соль меньше значение К - константы диссоциации больше
- 11. Смещение равновесия гидролиза Гидролиз по катиону: R++ HOH ROH + H+ Гидролиз по аниону: А− +
- 12. Ионное уравнение гидролиза СH3COO− + HOH СH3COOH + OH− Степень гидролиза Концентрация ионов Н+ и рН
- 13. соль образована сильным основанием и слабой одноосновной кислотой, гидролиз идет по аниону NaNO2 = Na+ +
- 14. Гидролиз соли К2СО3 K2CO3 = 2K+ + CO32− Соль образована сильным основанием и слабой двухосновной кислотой.
- 15. По первой ступени: По второй ступени: Расчет констант гидролиза К2СО3 Модуль 2. Лекция 10. Гидролиз солей
- 16. Гидролиз соли Cd(NO3)2 Cd(NO3)2 = Cd2+ + 2NO3− Соль образована слабым основанием и сильной кислотой. Гидролиз
- 17. Гидролиз соли CH3COONH4 Модуль 2. Лекция 10. Гидролиз солей Соль образована слабым основанием и слабой одноосновной
- 18. Гидролиз солей слабых кислот и слабых оснований Модуль 2. Лекция 10. Гидролиз солей Соли слабого основания
- 19. Необратимый совместный гидролиз - с участием катионов Al3+, Fe3+, Cr3+, NH4+ и анионов проходит с образованием
- 20. Заключение Гидролиз соли ‑ процесс обменного взаимодействия ионов соли с молекулами воды Гидролизу подвергаются соли, образованные
- 22. Скачать презентацию
 Химия как компонент системы естественнонаучного образования
Химия как компонент системы естественнонаучного образования Алкадиены
Алкадиены Хинолин және хинуклидин, 4- жағдайда алмасқан хинолин туындыларының дәрілік заттарын талдау
Хинолин және хинуклидин, 4- жағдайда алмасқан хинолин туындыларының дәрілік заттарын талдау Хімічне виробництво сталі
Хімічне виробництво сталі Использование уксусной кислоты в жизни
Использование уксусной кислоты в жизни Теория сплавов
Теория сплавов Кислотно-основные равновесия в водном растворе. Буферные растворы. (Лекция 3)
Кислотно-основные равновесия в водном растворе. Буферные растворы. (Лекция 3) Тепловой эффект химических реакций
Тепловой эффект химических реакций проект по биологииНаучно-исследовательская работа
проект по биологииНаучно-исследовательская работа Углеводы. Моносахариды
Углеводы. Моносахариды Обезвреживающая функция печени
Обезвреживающая функция печени Химическая связь. Ковалентная связь
Химическая связь. Ковалентная связь Строение вещества. Диффузия. Броуновское движение
Строение вещества. Диффузия. Броуновское движение Коррозия и защита строительных материалов
Коррозия и защита строительных материалов Чисті речовини та суміші. (7 клас)
Чисті речовини та суміші. (7 клас) Обчислення за хімічними рівняннями відносного виходу продукту реакції
Обчислення за хімічними рівняннями відносного виходу продукту реакції Показатели жесткости воды
Показатели жесткости воды Полисахариды. Крахмал и целлюлоза
Полисахариды. Крахмал и целлюлоза Химические свойства карбоновых кислот
Химические свойства карбоновых кислот Электролиты и неэлектролиты. Механизм электролитической диссоциации
Электролиты и неэлектролиты. Механизм электролитической диссоциации Углеводы. Моносахариды
Углеводы. Моносахариды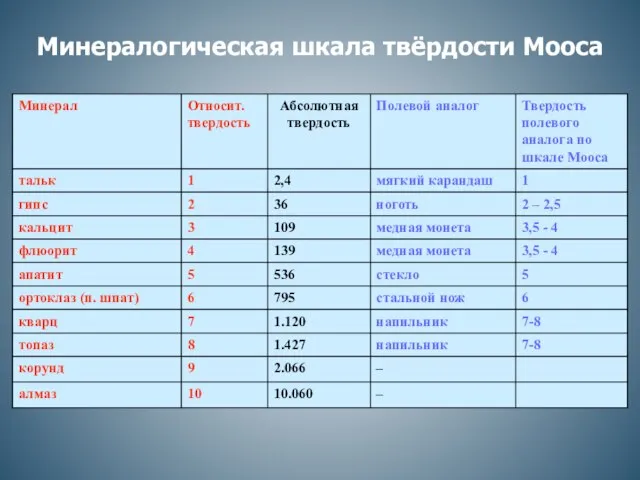 Минералогическая шкала твёрдости Мооса
Минералогическая шкала твёрдости Мооса Фазовые и агрегатные состояния полимеров
Фазовые и агрегатные состояния полимеров Неон. Физические свойства
Неон. Физические свойства Геохимия
Геохимия Минерал хромдиопсид. Месторождения
Минерал хромдиопсид. Месторождения Относительная молекулярная масса вещества. Задачи
Относительная молекулярная масса вещества. Задачи Коррозия материалов
Коррозия материалов