Содержание
- 2. Коррозия материалов Традиционное определение: Коррозия – это самопроизвольное разрушение конструкционных материалов при их химическом, электрохимическом и
- 3. Коррозия конструкционных материалов С коррозией конструкционных материалов (разрушением их под действием окружающей среды) все отрасли техники
- 4. Коррозия материалов Часто вместо понятия коррозия используют термин: химическое сопротивление материала в окружающей среде. Более современное
- 5. Основы коррозии и защиты металлов 18 лекций (36 час) 36 часов лабораторного практикума (6 лабораторных работ
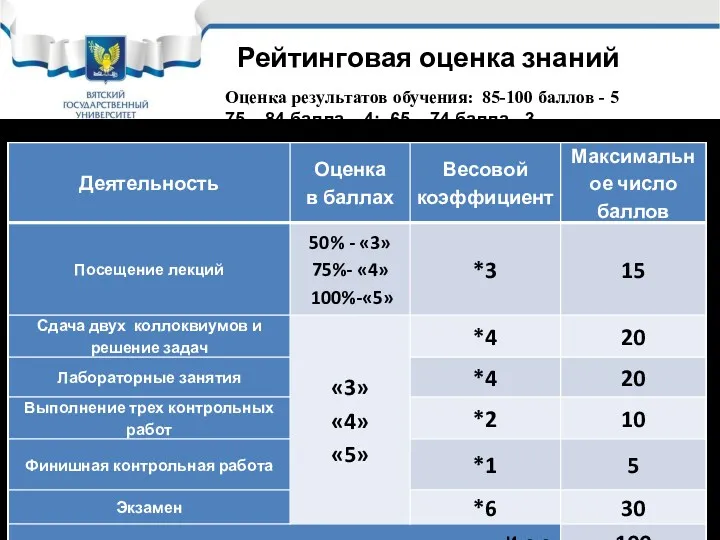
- 6. Рейтинговая оценка знаний Оценка результатов обучения: 85-100 баллов - 5 75 – 84 балла – 4;
- 7. Литература Основная литература Семенова, И.В. Коррозия и защита от коррозии: Учеб. пособие / И.В. Семенова, Г.М.
- 8. Литература Дополнительная 4. Шлугер М.А. Ажогин Ф.Ф., Ефимов Е.А. Коррозия и защита металлов: Учеб. пособие. –
- 9. Периодика Журнал «Защита металлов» с 2008 г «Физикохимия поверхности и защита металлов», 6 раз в год.
- 10. Важность изучения курса Необходимость и важность изучения курса «Основы коррозии и защиты металлов» вызывают 4 основные
- 11. Коррозия металлов приносит в любом развитом государстве гигантские экономические потери, которые составляют от 6% до 12%
- 12. Научно-технический аспект Зачастую развитие целого ряда направлений в технике часто связано с предварительным решением коррозионных проблем:
- 13. Экологический аспект Коррозия приводит к безвозвратным потерям материалов , что в свою очередь вызывает дефицит в
- 14. Социальный аспект Обострение международных отношений из-за нехватки сырья; Социальная напряженность из-за аварий вызываемых коррозией и загрязнениями
- 15. Типы коррозии В системе ЕСЗКС есть очень старый ГОСТ 1968 года, который называется «Термины коррозии». Согласно
- 16. Модуль 1. Химическая коррозия Слайд1 Химической коррозией называется самопроизвольный процесс разрушения металлов под действием сухих газов
- 17. Химическая коррозия Сухой воздух Топочные газы Нефть и продукты её перегонки Органические жидкости Газовая коррозия Коррозия
- 18. Первопричиной химической коррозии металлов является их термодинамическая неустойчивость в различных средах при данных внешних условиях, т.е.
- 19. Термодинамика химической коррозии металлов Принципиальная возможность или невозможность самопроизвольного протекания химического процесса определяется знаком изменения термодинамического
- 20. Расчет изменения изобарно-изотермического потенциала Если изобарно-изотермический потенциал при протекании какой-либо реакции уменьшается , т.е. ΔG Для
- 21. Расчет изменения изобарно-изотермического потенциала Для реакции окисления металла О2 (P,T=const) : mMe(T) + mn/4O2(г) = MemOmn/2(T),
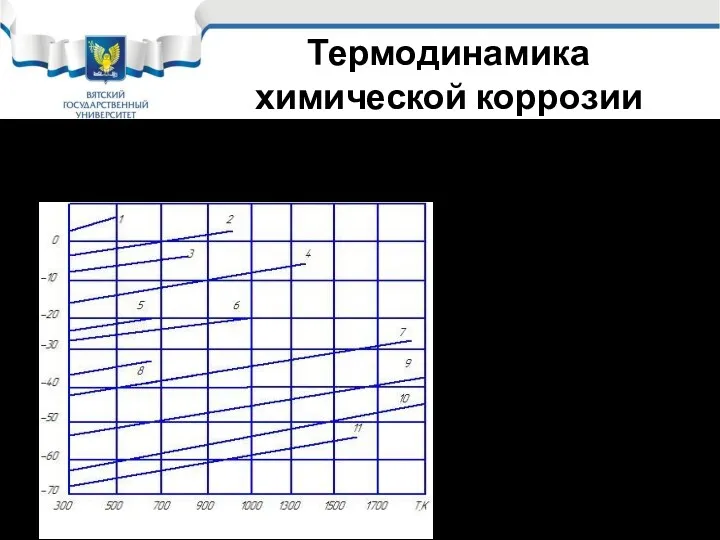
- 22. Термодинамика химической коррозии металлов Влияние температуры на ∆G/mn образования оксидов металлов: 1 – Au2O3; 2 –
- 23. Термодинамика химической коррозии металлов Таким образом согласно термодинамическим оценкам все технические металлы, за исключением золота, должны
- 24. Модуль 1. Химическая коррозия Лекция 1.1 При химической газовой коррозии можно выделить 2 основных этапа :
- 25. Кинетика химической коррозии Все эти стадии протекают быстро, поэтому коррозия на первоначальном этапе идет быстро для
- 26. Кинетика химической коррозии 2-ой этап, этап роста оксида зависит от того какой получается оксид: сплошной или
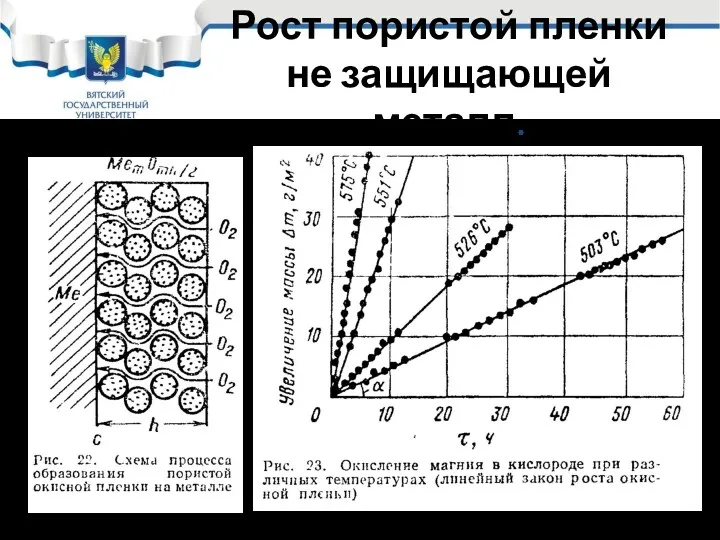
- 27. Кинетика химической коррозии При образовании пористой пленки, когда Vок/VМе кислород воздуха легко проникает через поры к
- 28. Рост пористой пленки не защищающей металл.
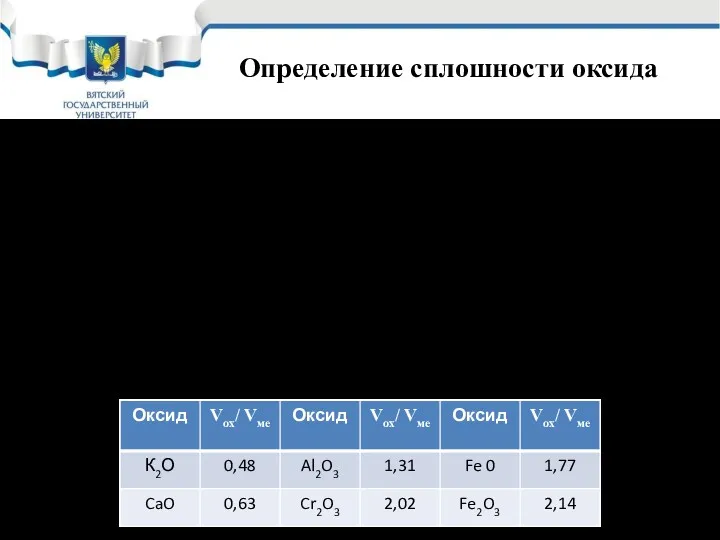
- 29. Сплошная защитная пленка не может получиться также, если Vок/VМе >2,5÷3,5. В этом случае в пленке возникают
- 30. Модуль 1. Химическая коррозия Лекция 1.1 Сплошная защитная пленка образуется, если выполняется условие сплошности: 1 где
- 31. Определение сплошности оксида Узнать какой получается оксид сплошной или не сплошной можно расчетным путем: Для этого
- 32. Химическая (газовая) коррозия при образовании сплошного оксида Таким образом, все технические металлы дают сплошной оксид, т.е.
- 33. Модуль 1. Химическая коррозия Лекция 1.1 2- ой этап роста оксида (сплошная пленка) Стадийность процесса коррозии
- 34. Кинетика химической коррозии Из перечисленных стадий наиболее замедленными являются: Перенос ионов металла Me2+ в слое оксида
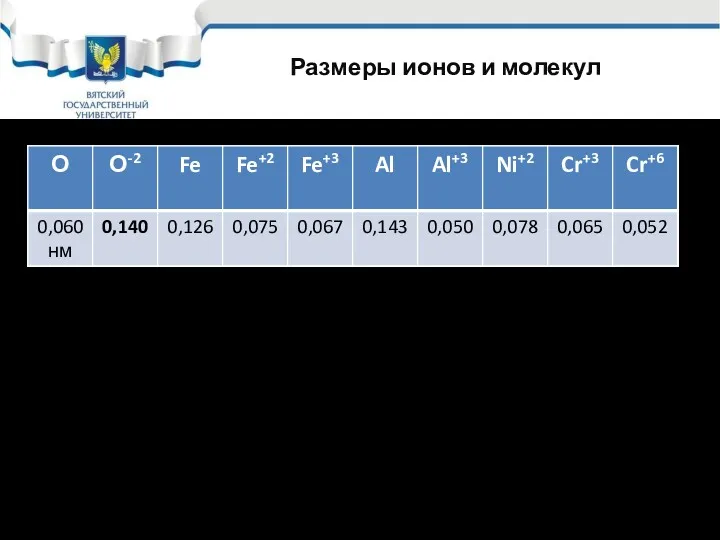
- 35. Размеры ионов и молекул Таким образом, более быстро движутся ионы металла Ионы в оксиде движутся за
- 36. Кинетика химической коррозии Упорядоченность, плотность оксида зависит от 3-х факторов:: температуры; состава коррозионной среды; природы металла.
- 37. Модуль 1. Химическая коррозия Лекция 1.1 2 Ме + О2 = 2МеО (1) При низких температурах
- 38. Модуль 1. Химическая коррозия Лекция 1.1 Сначала оксид МеО растет быстро, а затем рост оксида затрудняется,
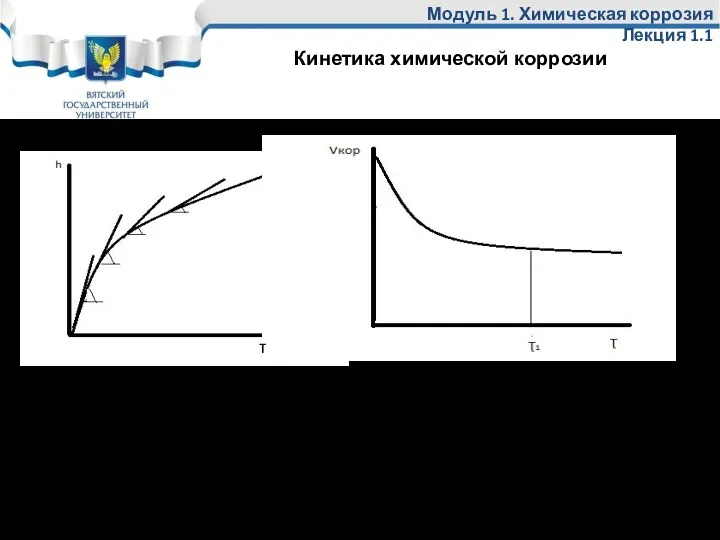
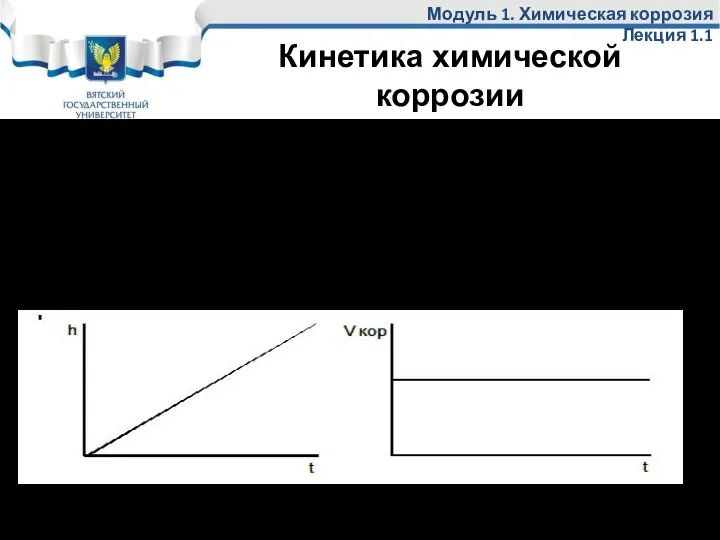
- 39. Модуль 1. Химическая коррозия Лекция 1.1 Скорость коррозии резко снижается во времени и после τ1 коррозия
- 40. Модуль 1. Химическая коррозия Лекция 1.1 При температуре больше 300°С скорость реакции (1) увеличивается, ионы не
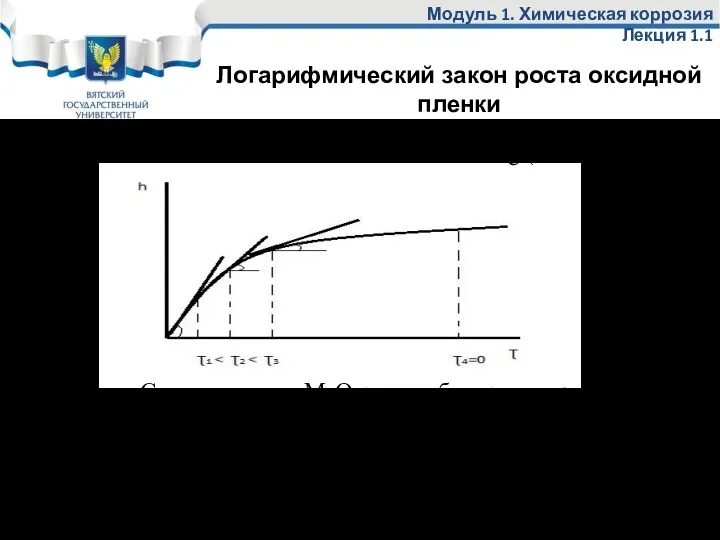
- 41. Модуль 1. Химическая коррозия Лекция 1.1 Кинетика химической коррозии Параболический закон роста оксидной пленки τ Изменение
- 42. Кинетика химической коррозии Для каждого металла существует своя температура перехода к параболическому закону – температура окалинообразования.
- 43. Кинетика химической коррозии Переход от логарифмического закона к параболическому не идет скачком. В некотором интервале температур
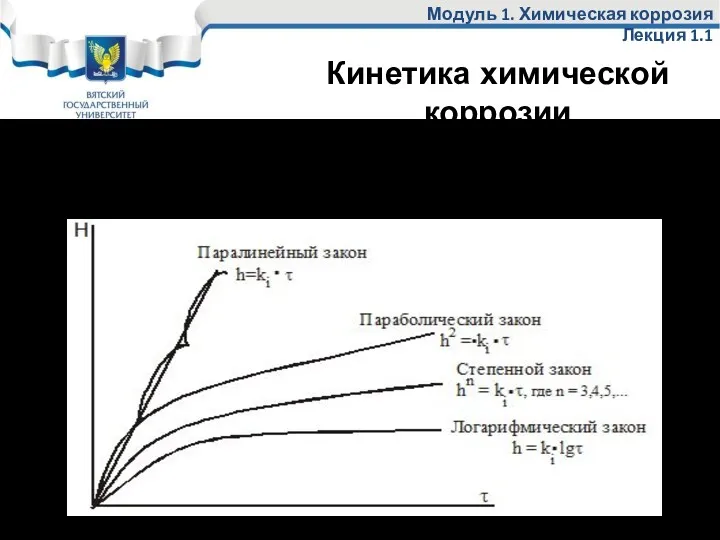
- 44. Модуль 1. Химическая коррозия Лекция 1.1 Изменение толщины оксида во времени при различных законах роста оксидной
- 45. Кинетика химической коррозии При очень высоких температурах 800-900оС на металлах наблюдается паралинейный закон роста оксидной пленки.
- 46. Кинетика химической коррозии Модуль 1. Химическая коррозия Лекция 1.1 Изменение скорости коррозии во времени при различных
- 47. Модуль 1. Химическая коррозия Лекция 1.1 При очень высоких температурах близких к температуре плавления металла иногда
- 48. Влияние состава коррозионной среды на скорость химической коррозии Модуль 1. Химическая коррозия Лекция 1.1 В воздухе
- 49. Влияние состава коррозионной среды на скорость химической коррозии Модуль 1. Химическая коррозия Лекция 1.1 2) серосодержащие
- 50. Влияние состава коррозионной среды на скорость химической коррозии H2S при низких температурах не опасен, опасность возникает
- 51. Влияние состава коррозионной среды на скорость химической коррозии Модуль 1. Химическая коррозия Лекция 1.1 В атмосфере,
- 52. Поведение металла при высоких температурах описывается двумя характеристиками: Жаростойкость – способность металла сопротивляться химической коррозии при
- 53. Жаростойкий металл – это металл который даёт упорядоченный оксид до температуры близкой к температуре плавления. т.е.
- 54. Al: tпл = 658оС упорядоченная плёнка, упорядоченный оксид до температуры плавления tпл Сr: tпл = 1857оС
- 55. Поведение железа и его сплавов в условиях химической коррозии При химической коррозии железа, углеродистых и низколегированных
- 56. Поведение железа и его сплавов в условиях химической коррозии 575 0-200оС – γ Fe2O3 логарифмический закон
- 57. Поведение железа и его сплавов в условиях химической коррозии Строение окалины Fe2O3 Соотношение по толщине FeО
- 58. Vкор To Рис.1.5 Поведение железа в условиях химической коррозии 300 427 575 1 2 3 Влияние
- 59. Влияние состава коррозионной среды на газовую коррозию Fe Наиболее часто встречающаяся ситуация 3, поэтому можно сделать
- 61. Скачать презентацию

















































 Автомобильные бензины
Автомобильные бензины Кристаллическое строение и свойства металлов
Кристаллическое строение и свойства металлов Галогены - химические элементы 17-й группы периодической таблицы химических элементов Д.И. Менделеева
Галогены - химические элементы 17-й группы периодической таблицы химических элементов Д.И. Менделеева Calcium and magnesium. Formation of calcareous.water hardness
Calcium and magnesium. Formation of calcareous.water hardness Биологически важные гетероциклы
Биологически важные гетероциклы Кристаллическое состояние вещества
Кристаллическое состояние вещества Ретросинтез Wickerol A
Ретросинтез Wickerol A Anionic Polymerization
Anionic Polymerization Арилалкиламины, гидроксифенилалкиламины и их производные
Арилалкиламины, гидроксифенилалкиламины и их производные Электролитическая диссоциация химических элементов
Электролитическая диссоциация химических элементов Углерод. Общая характеристика элементов подгруппы углерода
Углерод. Общая характеристика элементов подгруппы углерода 530f2c0b0bb94f3085ed9ef5fc682ddb
530f2c0b0bb94f3085ed9ef5fc682ddb Ароматические углеводороды. Процессы производства. Направления использования
Ароматические углеводороды. Процессы производства. Направления использования Гетероатомные соединения нефти
Гетероатомные соединения нефти Химическая посуда и лабораторное оборудование
Химическая посуда и лабораторное оборудование Виды коррозии
Виды коррозии Пластмаси. Пластичні маси
Пластмаси. Пластичні маси Алициклді көмірсутекті қосылыстар
Алициклді көмірсутекті қосылыстар Сложные эфиры. 10 класс
Сложные эфиры. 10 класс Предмет біоорганічної хімії. Класифікація, номенклатура, електронні уявлення, будова, реакційна здатність органічних сполук
Предмет біоорганічної хімії. Класифікація, номенклатура, електронні уявлення, будова, реакційна здатність органічних сполук Альдегиды и кетоны
Альдегиды и кетоны Лекции по курсу конструкционные и биоматериалы
Лекции по курсу конструкционные и биоматериалы Электролитическая диссоциация. Реакции ионного обмена
Электролитическая диссоциация. Реакции ионного обмена Results of lab test NG RO: Bypass, UV-lamp, membrane Toray 3012 800-1000 GPD
Results of lab test NG RO: Bypass, UV-lamp, membrane Toray 3012 800-1000 GPD Будова та властивості твердих тіл. Анізотропія кристалів. Рідкі кристали
Будова та властивості твердих тіл. Анізотропія кристалів. Рідкі кристали Аминокислоты. Пептиды. Белки
Аминокислоты. Пептиды. Белки Water
Water Изучение свойств горных пород, минералов и полезных ископаемых
Изучение свойств горных пород, минералов и полезных ископаемых