Содержание
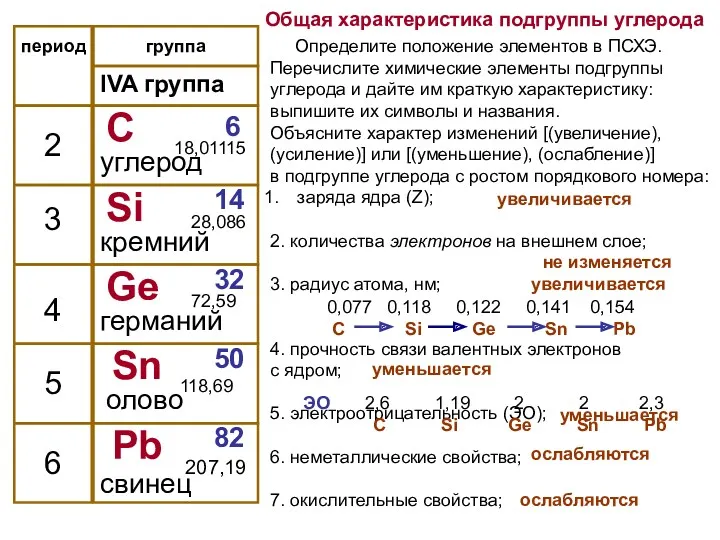
- 2. период IVA группа 2 3 4 5 С Si Ge Sn Pb 6 14 32 50
- 3. Углерод – химический элемент Положение углерода в ПСХЭ. Строение атома углерода 2. Сравнение строения атома углерода
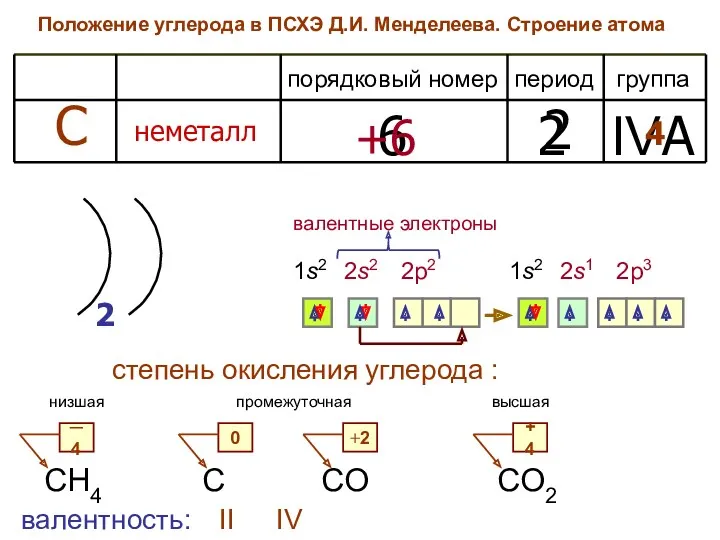
- 4. Положение углерода в ПСХЭ Д.И. Менделеева. Строение атома период группа порядковый номер С неметалл 6 2
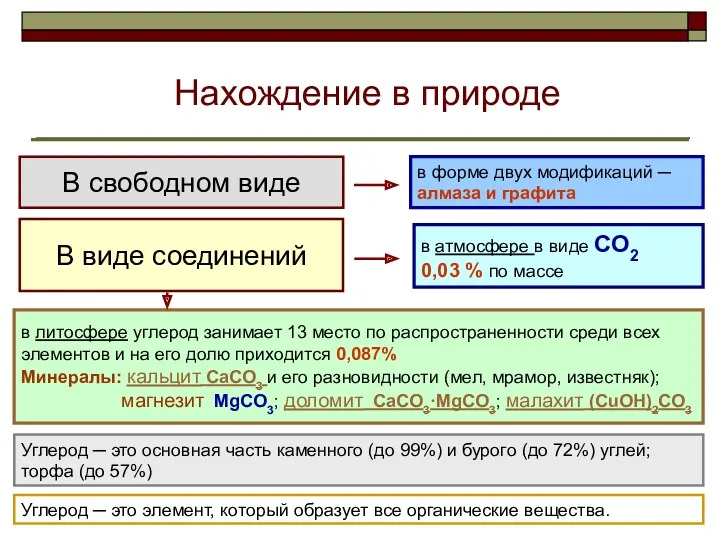
- 5. Нахождение в природе В свободном виде В виде соединений в атмосфере в виде СО2 0,03 %
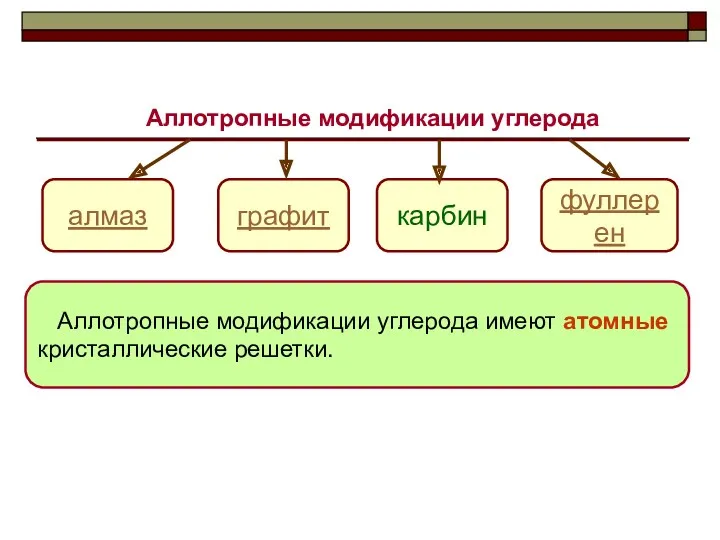
- 6. Аллотропные модификации углерода алмаз фуллерен карбин графит Аллотропные модификации углерода имеют атомные кристаллические решетки.
- 7. Алмаз С* В возбужденном состоянии атом углерода может образовывать четыре ковалентные связи. В алмазе все валентные
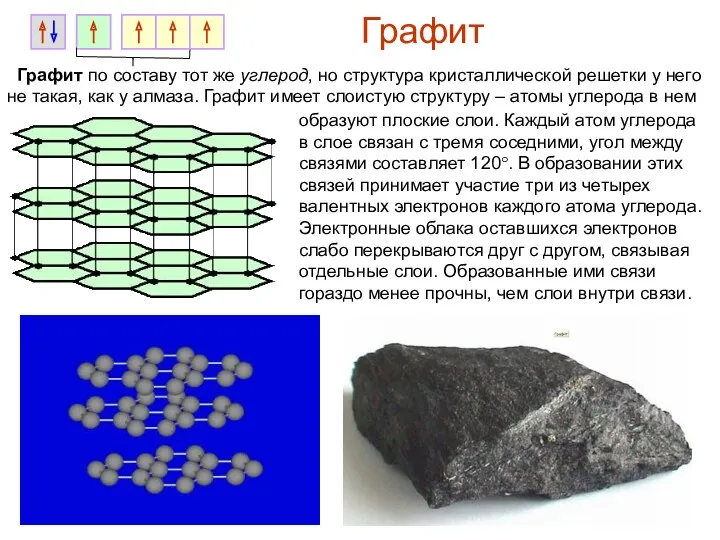
- 8. Графит Графит по составу тот же углерод, но структура кристаллической решетки у него не такая, как
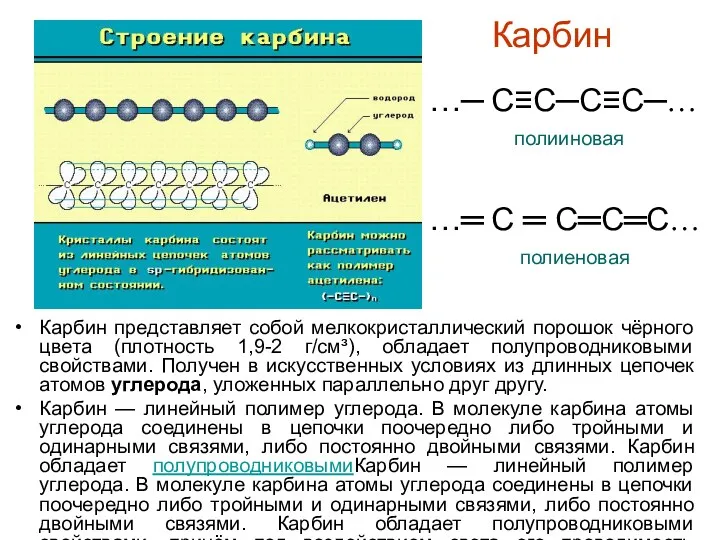
- 9. Карбин представляет собой мелкокристаллический порошок чёрного цвета (плотность 1,9-2 г/см³), обладает полупроводниковыми свойствами. Получен в искусственных
- 10. Фуллерены. Это твердые кристалли-ческие вещества, растворимые в органических растворителях, с образованием ярко окрашен-ных растворов. Молекулы фуллеренов
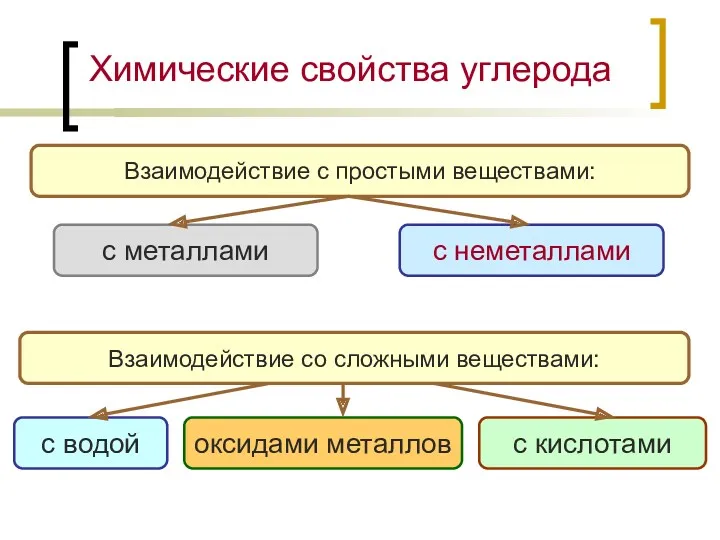
- 11. Химические свойства углерода Взаимодействие с простыми веществами: с металлами с неметаллами Взаимодействие со сложными веществами: с
- 12. С металлами углерод образует карбиды. 4C0 + 3Al0 = Al4+3C3−4 C0 + 4e → C−4 4
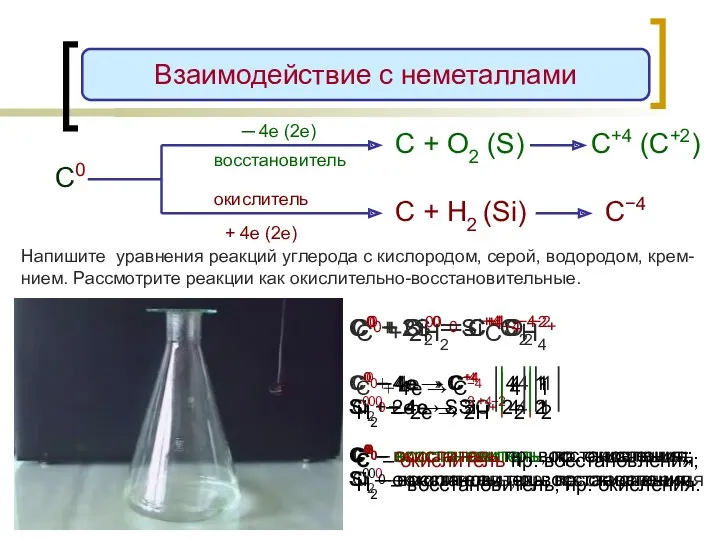
- 13. С0 ─ 4е (2е) + 4е (2е) восстановитель окислитель С + О2 (S) С + H2
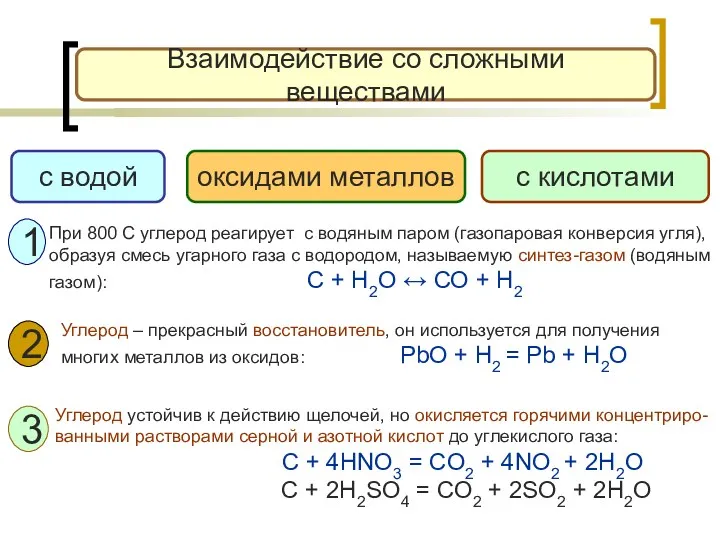
- 14. Взаимодействие со сложными веществами с водой оксидами металлов с кислотами 2 3 1 При 800 С
- 15. Соединения углерода 1. Оксид углерода(II) 3. Угольная кислота и ее соли 2. Оксид углерода(IV)
- 16. Оксид углерода (II) Состав. Строение 2. Получение а) в лаборатории б) в промышленности 5. Химические свойства
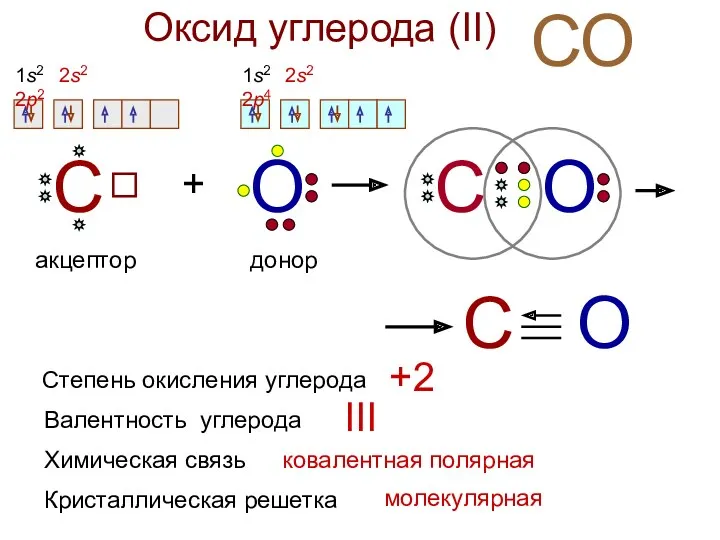
- 17. Оксид углерода (II) СО С + О С О С О донор акцептор Степень окисления углерода
- 18. Получение оксида углерода (II) При действии на муравьиную кислоту водоотнимающими средствами происходит ее обезвоживание: 120°С, Н2SO4
- 19. Монооксид углерода представляет собой бесцветный и неимеющий запаха газ, малорастворимый в воде. Растворимость СО в воде
- 20. На человека угарный газ воздействует как сильнодействующий яд. Сущность отравления угарным газом состоит в том, что
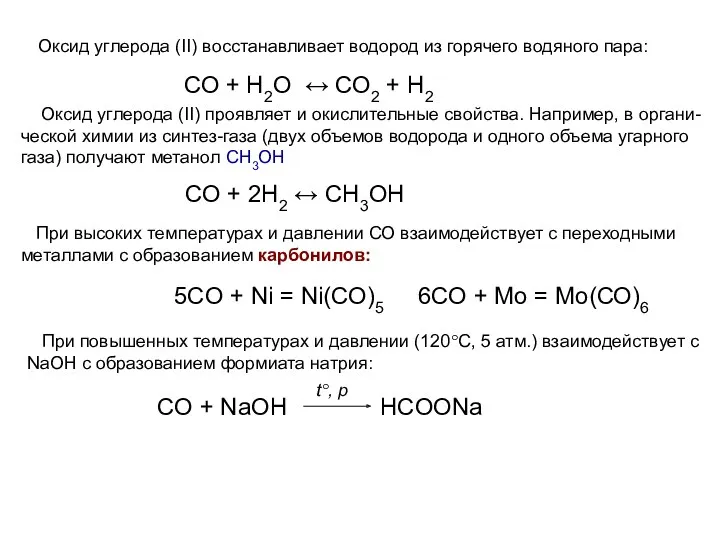
- 21. Химические свойства оксида углерода (II) Угарный газ реагирует с пероксидом натрия Na2O2 с образованием соды –
- 22. Оксид углерода (II) восстанавливает водород из горячего водяного пара: СО + Н2О ↔ СО2 + Н2
- 23. Применение оксида углерода (II) 1. Угарный газ служит сырьем для получения метилового спирта и некоторых других
- 24. Оксид углерода (IV) cолеобразующий кислотный оксид Состав. Строение. 2. Физические свойства. 3. Получение: а) в лаборатории;
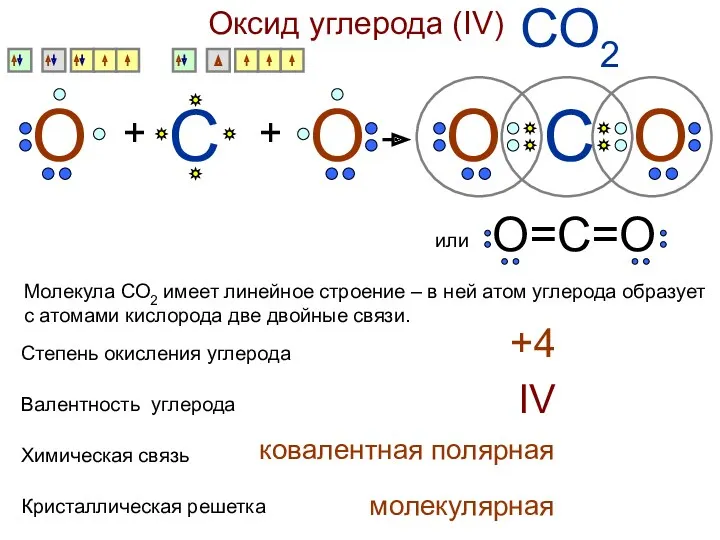
- 25. Оксид углерода (IV) СО2 С О + О + О О С О=С=О или Степень окисления
- 26. Физические свойства оксида углерода (IV) Dвоздуху(СО2) M(СО2) M(воздуха) = 29г/моль 44г/моль = 1,5 = = агрегатное
- 27. Физические свойства углекислого газа Углекислый газ в зависимости от давления и температуры может находится в газообразном,
- 28. Содержание углекислого газа в атмосфере Земли сейчас самое высокое за последние 650 тысяч лет. Увеличение его
- 29. Получение и распознавание углекислого газа Составьте уравнение реакции получения углекислого газа в лаборатории СаСО3 + 2HCl
- 30. Получение углекислого газа в промышленности 3. из отходящих газов химических производств, прежде всего синтетического аммиака и
- 31. Химические свойства оксида углерода (IV) Взаимодействие с водой: Углекислый газ растворим в воде: при 20 С
- 32. 4. Взаимодействие с магнием: Составьте уравнение реакции взаимодействия углекислого газа с магнием. Рассмотрите с т. зр.
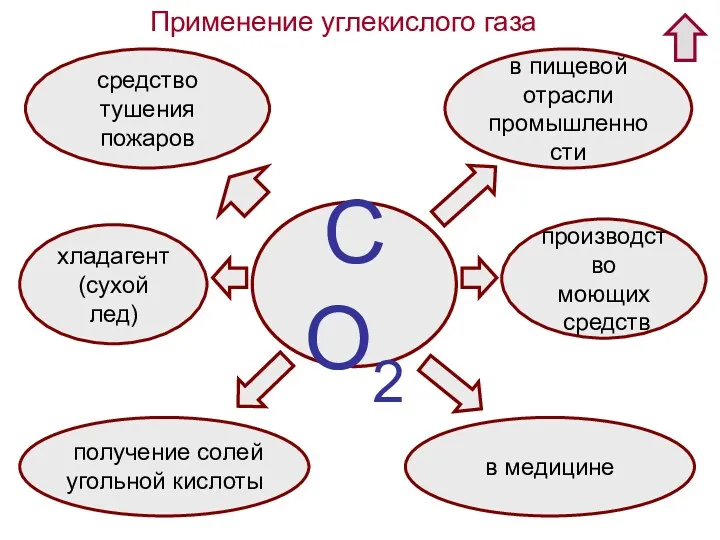
- 33. Применение углекислого газа СО2 хладагент (сухой лед) средство тушения пожаров в пищевой отрасли промышленности производство моющих
- 34. Угольная кислота и ее соли 1. Состав. Строение 2. Классификация 3. Соли угольной кислоты 4. Качественная
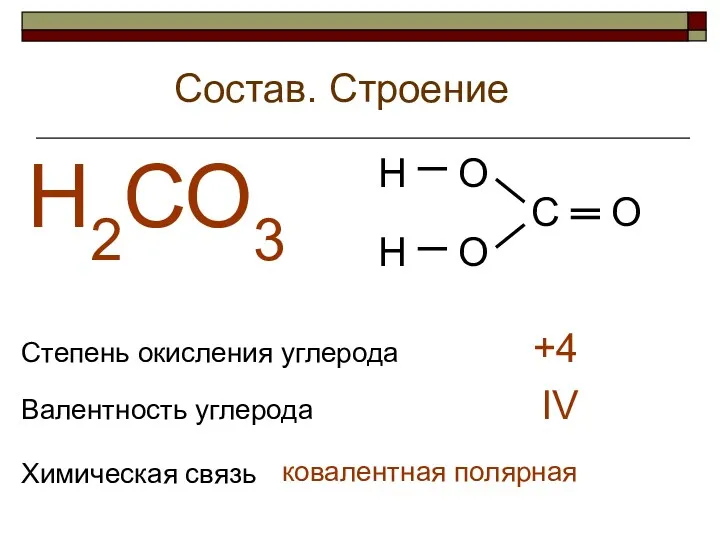
- 35. Состав. Строение Н2СО3 Степень окисления углерода Валентность углерода +4 IV Химическая связь ковалентная полярная Н Н
- 36. Угольная кислота (Н2СО3). Классификация. наличию кислорода: основности: растворимости в воде: степени электролитической диссоциации: стабильности: кислородная двухосновная
- 37. Соли угольной кислоты карбонаты гидрокарбонаты Составьте уравнения реакций получения карбоната кальция, перехода карбоната в гидрокарбонат. Са(ОН)2
- 39. Скачать презентацию






















 Rhodium
Rhodium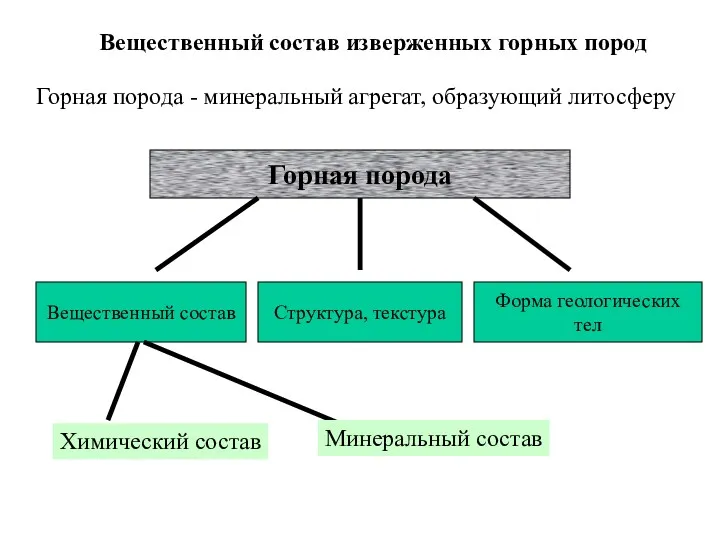 Вещественный состав изверженных горных пород
Вещественный состав изверженных горных пород Химический факультет
Химический факультет Жорсткість води і методи її усунення. 11 клас
Жорсткість води і методи її усунення. 11 клас Полисахариды: крахмал и целлюлоза
Полисахариды: крахмал и целлюлоза Сплавы металлов. 11 класс
Сплавы металлов. 11 класс Ароматические углеводороды (арены)
Ароматические углеводороды (арены) Камни и Телец
Камни и Телец Основы кристаллографии
Основы кристаллографии Мир кристаллов
Мир кристаллов Значение периодического закона
Значение периодического закона Кремний. Применение кремния
Кремний. Применение кремния Циклические углеводороды. Циклоалканы
Циклические углеводороды. Циклоалканы Биологически активные вещества и их содержание в лекарственных растениях
Биологически активные вещества и их содержание в лекарственных растениях Закономерность изменений в строении электронных оболочек атома
Закономерность изменений в строении электронных оболочек атома Основания. 8 класс
Основания. 8 класс Железо и его соединения
Железо и его соединения Кинетическое уравнение математическая запись закона действующих масс
Кинетическое уравнение математическая запись закона действующих масс Катионная полимеризация (Лекция 6)
Катионная полимеризация (Лекция 6) Циклоалканы. 10 класс
Циклоалканы. 10 класс Классификация химических реакций в органической и неорганической химии
Классификация химических реакций в органической и неорганической химии Строение атома
Строение атома Роль химии в жизни человека
Роль химии в жизни человека Палладий. История открытия химических веществ
Палладий. История открытия химических веществ Геология полезных ископаемых
Геология полезных ископаемых Типы химических реакций
Типы химических реакций Криминалистическое исследование нефтепродуктов, горючесмазочных материалов, спиртосодержащих жидкостей,
Криминалистическое исследование нефтепродуктов, горючесмазочных материалов, спиртосодержащих жидкостей, Химические реакции
Химические реакции