Слайд 2
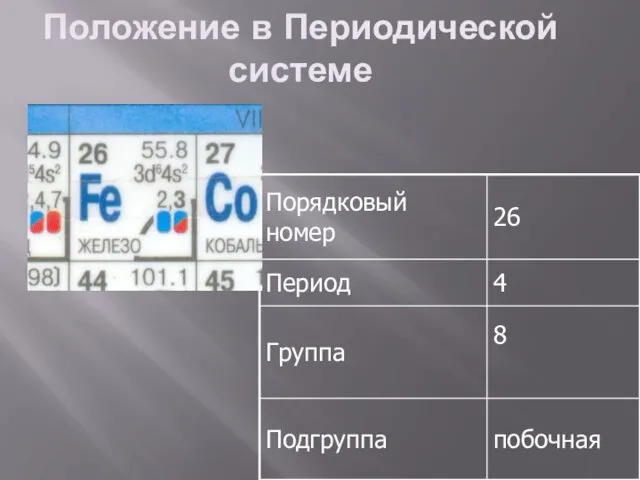
Положение в Периодической системе
Слайд 3

Строение атома
С. О. : +2, +3
Слайд 4

Нахождение в природе.
ХАЛЬКОПИРИТ
Fe
ЧЁРНЫЙ ПИРИТ
ПИРИТ
ГЕМАТИТ
Слайд 5

Важнейшие железные руды
магнитный железняк Fe3O4
красный железняк Fe2O3
бурый железняк Fe2O3 ∙ 3H2O
железный
колчедан FeS2
Слайд 6

Важнейшие соединения железа
Соль Мора: FeSO4·(NH4)2SO4·6H2O.
Представляет собой парамагнитные, неярко сине-зелёные моноклинные
кристаллы. Устойчива на воздухе. Соль Мора используется в медицине (добавляется в пищу, или в виде фармакопейного препарата, при нехватке в организме больного железа), для пропитки древесины для защиты её от гниения.
Железный купорос FeSO4·7Н2О. Применяется в текстильной промышленности, в сельском
хозяйстве как фунгицид, для
приготовления минеральных красок.
Слайд 7

Роль железа в жизнедеятельности организмов.
Ионы Fe необходимы для питания и дыхания
растений
Повышают яркость зелёной
Окраски растений
В случае потери зелёной окраски растение лечат железным купоросом FeSO4 7H2O
Ион Fe2+ - зелёная окраска листьев, плодов растений
Слайд 8

Роль железа в жизнедеятельности организмов.
Ион Fe3+ - красная окраска листьев, плодов.
Слайд 9
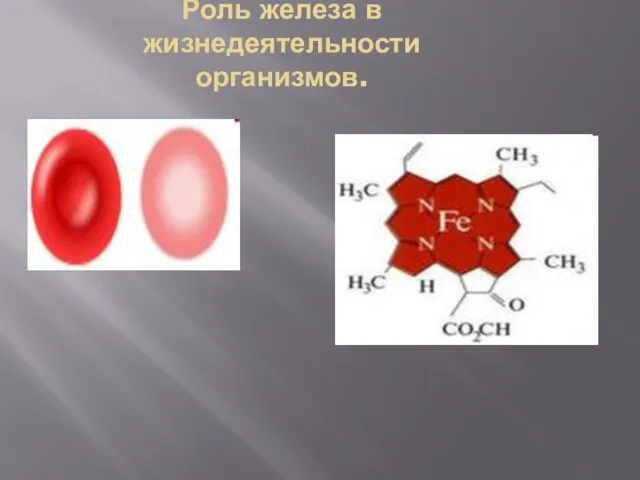
Роль железа в жизнедеятельности организмов.
Слайд 10

Слайд 11

Физические свойства
Твердое
Серо-серебристое
Блестящее
Хорошо проводит тепло и электрический ток
Достаточно ковкое и пластичное
Обладает магнитными
свойствами
Слайд 12

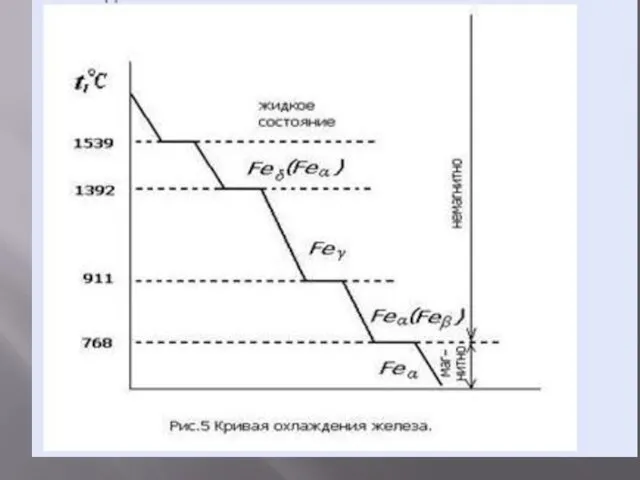
Свойство металла при повышении температуры приобретать разные кристаллические решетки, а, следовательно,
и разные физико-механические свойства, принято называть аллотропией или полиморфизмом.
Полиморфные модификации обозначают строчными греческими буквами α, β, γ, δ и т. д., причем α соответствует модификации, существующей при наиболее низкой температуре.
Полиморфизм характерен для железа, олова, кобальта, марганца, титана и некоторых других металлов.
Слайд 13
Слайд 14
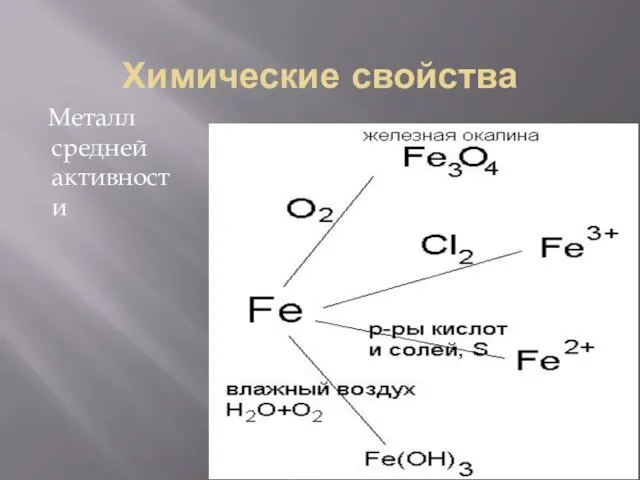
Химические свойства
Металл средней активности
Слайд 15

Химические свойства
3Fe + 2O2 = Fe3O4
2Fe + 3Cl2 = 2FeCl3
Fe +
2HCl = FeCl2 + H2
Fe + S = FeS
Fe + CuSO4 = FeSO4 + Cu
Fe + O2 + H2O = Fe(OH)3
Слайд 16

Концентрированные азотная и серная кислоты при комнатной температуре пассивируют железо, а
при нагревании реакции протекают следующим образом:
2Fe + 6H2SO4 = t Fe2(SO4)3 + 3SO2↑ +6H2O
конц.
Fe + 4HNO3 → Fe(NO3)3 + NO↑ +2H2O
25%
Слайд 17

Слайд 18

Слайд 19

ГИДРОКСИД ЖЕЛЕЗА (II) Fe(OH)2.
Получают гидроксид железа (II) следующим образом:
FeSO4 + 2NaOH
→ Fe(OH)2↓ + Na2SO4
Гидроксид железа (II) окисляется кислородом воздуха до гидроксида железа (III):
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3↓
воздух красно-бурый
Сульфат железа (II) в окислительно-восстановительных реакциях может быть восстановителем:
10FeSO4+8H2SO4+2KMnO4→5Fe2(SO4)3+2MnSO4+K2SO4+8H2O
Слайд 20

Доказательство амфотерности Fe2O3 и Fe(OH)3.
Fe2O3 + 3H2SO4 →Fe2(SO4)3 + 3H2O
Fe2O3 +
2NaOH + 3H2O → 2Na[Fe(OH)4]
2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + 6H2O
Fe(OH)3 + 3NaOH → Na3[Fe(OH)6]
Fe(OH)3 + NaOH → Na[Fe(OH)4]
Слайд 21

Качественные реакции на Fe 2+
FeCl2+2NaOH?Fe(OH)2 + 2NaCl
зеленый
2. FeCl2 + K3(Fe(CN)6)
?
красная кровяная соль
KFe(Fe(CN)6) + 2KCl
«турнбуллева синь»
Слайд 22

Качественные реакции на Fe 3+
FeCl3+3NaOH?Fe(OH)3 + 3NaCl
бурый
2. FeCl3 + K4(Fe(CN)6)
?
желтая кровяная соль
KFe(Fe(CN)6) + 3KCl
«берлинская лазурь»
Слайд 23























 Взаимодействия кислорода с металлом
Взаимодействия кислорода с металлом Соли (12 класс)
Соли (12 класс) Хімічний зв’язок
Хімічний зв’язок Токсичні характеристики найбільш розповсюджених небезпечних хімічних речовин і симптоми ураження
Токсичні характеристики найбільш розповсюджених небезпечних хімічних речовин і симптоми ураження Пластмаси. Пластичні маси
Пластмаси. Пластичні маси Титриметрический метод анализа
Титриметрический метод анализа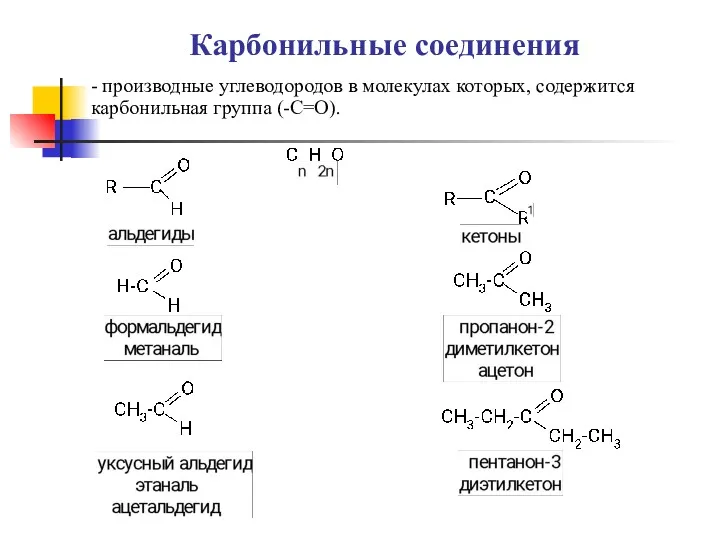 Карбоновые кислоты, альдегиды
Карбоновые кислоты, альдегиды Химическое равновесие в гомогенных системах. Ионное произведение воды. 12 класс
Химическое равновесие в гомогенных системах. Ионное произведение воды. 12 класс Положение тугоплавких металлов в Периодической системе элементов
Положение тугоплавких металлов в Периодической системе элементов Основания. Неорганические соединения
Основания. Неорганические соединения Жиры. История открытия, строение, классификация, свойства
Жиры. История открытия, строение, классификация, свойства Перманганат калия
Перманганат калия Массовая доля элемента в веществе
Массовая доля элемента в веществе Введение в химическую технологию топлив и углеродных материалов
Введение в химическую технологию топлив и углеродных материалов Высокомолекулярные соединения и супрамолекулярные структуры. (Лекция 3)
Высокомолекулярные соединения и супрамолекулярные структуры. (Лекция 3) Расчеты по химическим уравнениям. 8 класс
Расчеты по химическим уравнениям. 8 класс Акцепторы катионов и анионов. Краун-эфиры и близкие структурные аналоги: поданды, лариатэфиры. Супрамолекулярная фотоника
Акцепторы катионов и анионов. Краун-эфиры и близкие структурные аналоги: поданды, лариатэфиры. Супрамолекулярная фотоника Поверхностно-активные вещества (ПАВ). Классификация ПАВ по степени влияния на окружающую среду
Поверхностно-активные вещества (ПАВ). Классификация ПАВ по степени влияния на окружающую среду Кремний и его соединения. Нахождение в природе
Кремний и его соединения. Нахождение в природе Лекция №11 ДИСПЕРСНЫЕ СИСТЕМЫ И РАСТВОРЫ
Лекция №11 ДИСПЕРСНЫЕ СИСТЕМЫ И РАСТВОРЫ Кислоты
Кислоты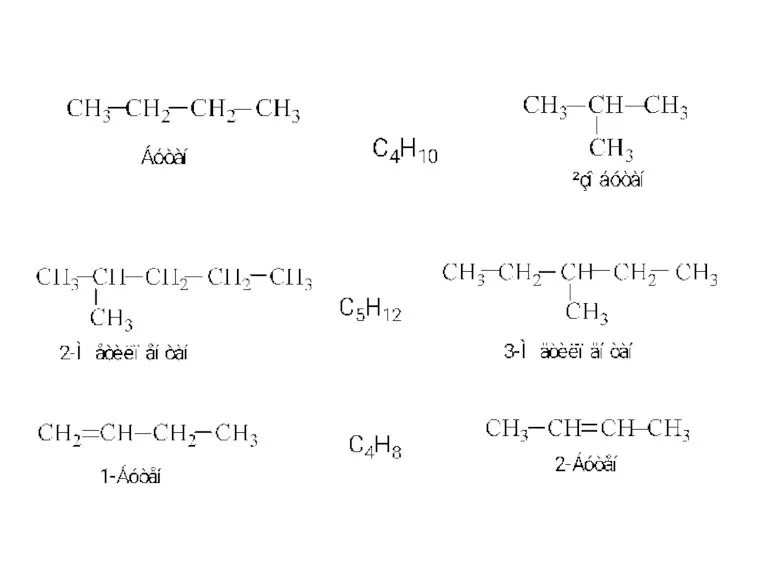 Структурна ізомерія
Структурна ізомерія Введение. Предмет и содержание фармацевтической химии, её связи с другими науками
Введение. Предмет и содержание фармацевтической химии, её связи с другими науками Менделеевские уроки. День науки
Менделеевские уроки. День науки Залежність властивостей полімерів від їхньої будови. Термопластичні й термореактивні полімери
Залежність властивостей полімерів від їхньої будови. Термопластичні й термореактивні полімери Сероводород и его свойства
Сероводород и его свойства Класифікація, будова та номенклатура органічних сполук
Класифікація, будова та номенклатура органічних сполук Непредельные углеводороды. Алкены. Номенклатура алкенов
Непредельные углеводороды. Алкены. Номенклатура алкенов