Слайд 2

"Тогда услышал я (о, диво!), запах скверный,
Как будто тухлое разбилося
яйцо,
Или карантинный страж курил жаровней серной.
Я, нос себе зажав, отворотил лицо..."
Пушкин А.С.
Слайд 3
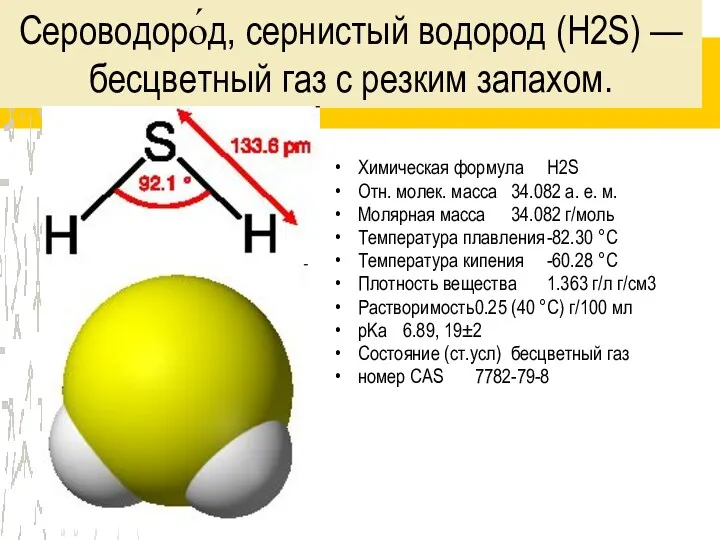
Сероводоро́д, сернистый водород (H2S) — бесцветный газ с резким запахом.
Химическая формула H2S
Отн.
молек. масса 34.082 а. е. м.
Молярная масса 34.082 г/моль
Температура плавления -82.30 °C
Температура кипения -60.28 °C
Плотность вещества 1.363 г/л г/см3
Растворимость 0.25 (40 °C) г/100 мл
pKa 6.89, 19±2
Состояние (ст.усл) бесцветный газ
номер CAS 7782-79-8
Слайд 4

Нахождение в природе
Встречается в природе в составе нефти, природного газа, вулканического
газа и в горячих источниках.
Слайд 5

Свойства
Термически неустойчив (при температурах больше 400 °C разлагается на простые вещества
— S и H2), ядовитый газ тяжелее воздуха с неприятным запахом тухлых яиц. Молекула сероводорода имеет угловую форму, поэтому она полярна (μ = 0,34·10-29 Кл·м). В отличие от молекул воды, молекулы сероводорода не образуют прочных водородных связей, поэтому H2S — газ. Насыщенный водный раствор H2S является сероводородной кислотой.
Слайд 6
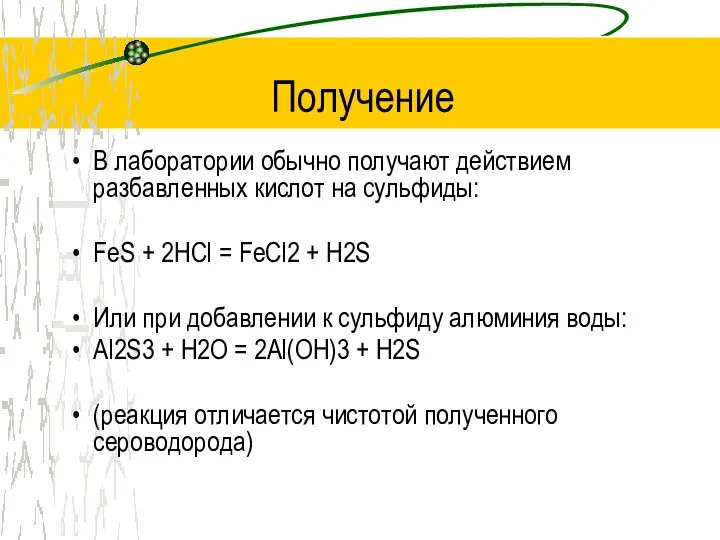
Получение
В лаборатории обычно получают действием разбавленных кислот на сульфиды:
FeS + 2HCl
= FeCl2 + H2S
Или при добавлении к сульфиду алюминия воды:
Al2S3 + H2O = 2Al(OH)3 + H2S
(реакция отличается чистотой полученного сероводорода)
Слайд 7

Применение
Сероводород из-за своей токсичности находит ограниченное применение.
В аналитической химии сероводород и
сероводородная вода используются как реагент для осаждения тяжёлых металлов, сульфиды которых очень слабо растворимы
В медицине — в составе сероводородных ванн
Сероводород применяют для получения серной кислоты, элементной серы, сульфидов
Используют в органическом синтезе для получения тиофена и меркаптанов
В последние годы рассматривается возможность использования сероводорода, накопленного в глубинах Чёрного моря, в качестве энергетического и химического сырья.
Слайд 8

Токсикология
Очень токсичен. При высокой концентрации однократное вдыхание может вызвать мгновенную смерть.
При небольших концентрациях довольно быстро возникает адаптация к неприятному запаху «тухлых яиц», и он перестаёт ощущаться. Во рту возникает сладковатый металлический привкус [2]
При большой концентрации не имеет запаха.
Слайд 9

Раствор сероводорода в воде — очень слабая сероводородная кислота
Диссоциация сероводородной кислоты
H2S
→ H+ + HS-
HS- ↔ H+ + S2-
Диссоциация по второй ступени практически не протекает, так как это слабая кислота.
Она дает 2 типа солей:
HS- S2-
гидросульфиды сульфиды
Слайд 10

Общие свойства кислот
Взаимодействуют:
-с основаниями
-основными и амфотерными оксидами
металлами
солями
Слайд 11

Качественная реакция на сульфид-ион
Лабораторный опыт
Pb(NO3)2 + Na2S → PbS↓ +
2NaNO3
осадок черного цвета
(Na2S + CuCl2 → CuS↓ + 2HCl)
осадок черного цвета
Слайд 12

Сероводород обладает свойствами восстановителя
Сероводород горит на воздухе голубым пламенем при
этом образуется сернистый газ или оксид серы(IV)
2H2S-2 + 3O2 → 2H2O + 2S+4O2↑
S-2 -6е→ S+4 Восстановитель
O2+4е → 2O -2 Окислитель
При недостатке кислорода образуются пары воды и серы:
2H2S-2 + O2 → 2H2O + 2S0
S-2 -2е→ S0 Восстановитель
O2+4е → 2O -2 Окислитель
Сероводород обладает свойствами восстановителя: если в пробирку с сероводородом прилить небольшое количество йодной воды, то раствор обесцветится и на поверхности раствора появится сера
H2S-2 + I02→ S0 + 2HI-1
S-2 -2е→ S0Восстановитель
I02 +2е → 2I-1 окислитель
Слайд 13

Влияние сероводорода на окружающую среду и здоровье человека
Очень токсичен. Вдыхание воздуха
с содержанием сероводорода вызывает головокружение, головную боль, тошноту, а со значительной концентрацией приводит к коме, судорогам, отёку лёгких и даже к летальному исходу. При высокой концентрации однократное вдыхание может вызвать мгновенную смерть. При небольших концентрациях довольно быстро возникает адаптация к неприятному запаху «тухлых яиц», и он перестаёт ощущаться. Во рту возникает сладковатый металлический привкус
При большой концентрации ввиду паралича обонятельного нерва запах сероводорода не ощущается












 Повторение и обобщение знаний по темам Металлы и сплавы.
Повторение и обобщение знаний по темам Металлы и сплавы. Особенности полимерного состояния вещества
Особенности полимерного состояния вещества Тағамдық қоспалардың функционалдық жүктелуі және олардың сипаттамасы
Тағамдық қоспалардың функционалдық жүктелуі және олардың сипаттамасы Нефть. Свойства нефти
Нефть. Свойства нефти Properties of Atoms and the Periodic Table
Properties of Atoms and the Periodic Table Функциональные производные с кратной связью C=“Э”. Часть 1. Карбонильные соединения и имины
Функциональные производные с кратной связью C=“Э”. Часть 1. Карбонильные соединения и имины Периодический закон и периодическая система Д.И. Менделеева. Вторичная периодичность. Тема №1
Периодический закон и периодическая система Д.И. Менделеева. Вторичная периодичность. Тема №1 ДикарбоновыеКислоты-1
ДикарбоновыеКислоты-1 История органической химии. Характерные особенности органических соединений
История органической химии. Характерные особенности органических соединений Спирти. Насичені одноатомні спирти: формули, ізомерія, систематична номенклатура
Спирти. Насичені одноатомні спирти: формули, ізомерія, систематична номенклатура Стекло. Виды стекол
Стекло. Виды стекол Реакции ионного обмена
Реакции ионного обмена Соединения галогенов
Соединения галогенов Химический элемент. Неон
Химический элемент. Неон Алкины
Алкины Спирты. Обобщающий урок
Спирты. Обобщающий урок Химия өнеркәсібі
Химия өнеркәсібі Современные представления о катализе. Общие закономерности гетерогенного катализа
Современные представления о катализе. Общие закономерности гетерогенного катализа Organic chemistry. Alcohols
Organic chemistry. Alcohols Классификация химических элементов
Классификация химических элементов Строение атома. Периодическая таблица Менделеева. Химическая связь
Строение атома. Периодическая таблица Менделеева. Химическая связь Основные положения теории растворов электролитов, используемых в аналитической химии
Основные положения теории растворов электролитов, используемых в аналитической химии Соединения железа
Соединения железа Типы химических реакций в органической химии
Типы химических реакций в органической химии Синтез высокомолекулярных соединений
Синтез высокомолекулярных соединений Химические методы выявления потожировых следов
Химические методы выявления потожировых следов Природные каменные материалы. (Лекция 3)
Природные каменные материалы. (Лекция 3) Правила безопасности в кабинете химии. Приёмы обращения с лабораторным оборудованием
Правила безопасности в кабинете химии. Приёмы обращения с лабораторным оборудованием