Содержание
- 2. Сегодня на уроке Обобщить и систематизировать знания по теме “Спирты” Закрепить знания о составе, строении и
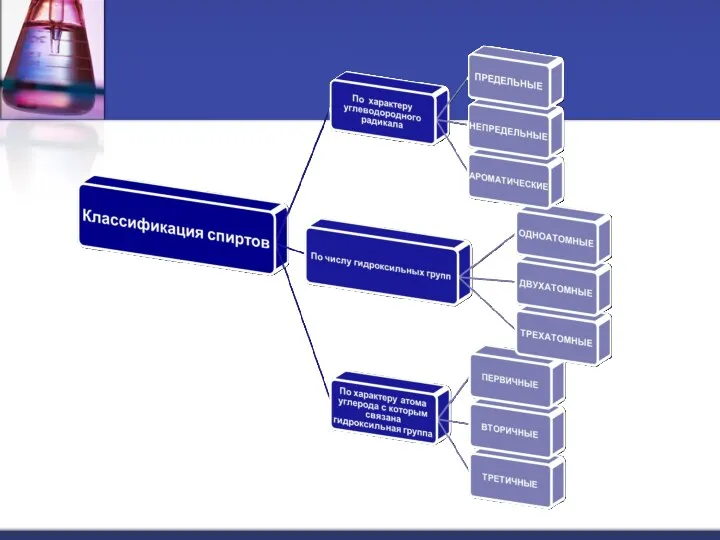
- 3. это органические вещества, молекулы которых содержат одну или несколько гидроксильных групп –ОН, соединенных с углеводородным радикалом.
- 5. Виды изомерии спиртов -изомерия положения - ОН группы, (начиная с С3) ; -углеродного скелета, (начиная с
- 6. Спиртам характерны следующие реакции: 1. Замещения: 2C 2H5OH + 2Na → 2C2H5O– Na + H2 этилат
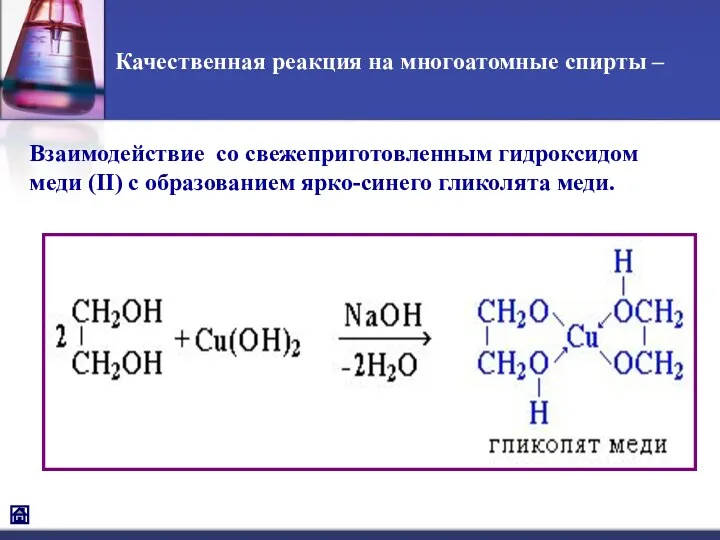
- 7. Качественная реакция на многоатомные спирты – Взаимодействие со свежеприготовленным гидроксидом меди (II) с образованием ярко-синего гликолята
- 8. Получение предельных одноатомных спиртов 1. Гидратация алкенов: 2. Восстановление альдегидов и кетонов: 3. Гидролиз галогеналканов: 4.
- 9. Применение метанола Для выпуска формальдегида уксусной кислоты ряда эфиров изопрена растворителей при производстве лаков применяют как
- 10. Действие метанола на организм Метанол — яд, действующий на нервную и сосудистую системы. Приём внутрь 5—10
- 11. Применение этиленгликоля Используется для изготовления антифризов получения полимеров, из которых изготовляют пластиковые бутылки и синтетическое волокно
- 12. Применение глицерина В 1866 г. А.Нобель изобрел динамит
- 13. Применение глицерина Применяется в производстве взрывчатых веществ бумаги; как компонент антифризов, некоторых клеев, в производстве кондитерских
- 14. Применение глицерина Кремы; Помады; Зубные пасты; Кондитерские изделия; Пластмассовые изделия; Изделия из кожи; Нитроглицерин
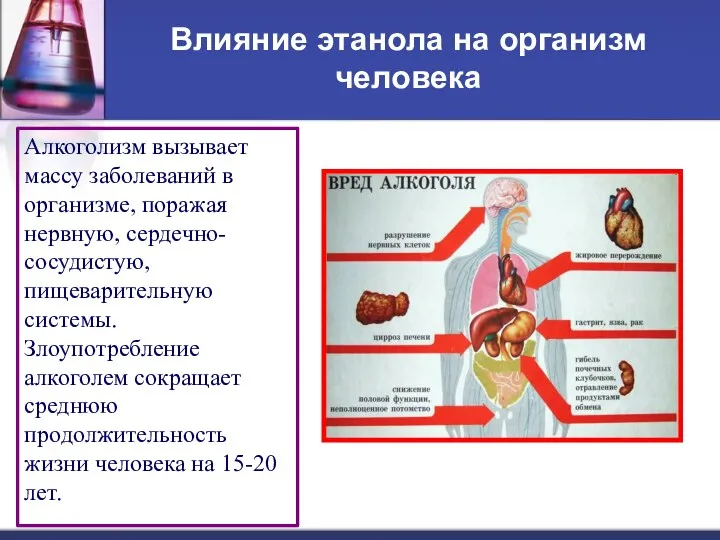
- 15. Влияние этанола на организм человека Алкоголизм вызывает массу заболеваний в организме, поражая нервную, сердечно- сосудистую, пищеварительную
- 17. Скачать презентацию











 История развития химии
История развития химии Непредельные углеводороды
Непредельные углеводороды Решение задач на нахождение молекулярной формулы органических веществ
Решение задач на нахождение молекулярной формулы органических веществ Лекции по курсу конструкционные и биоматериалы
Лекции по курсу конструкционные и биоматериалы Найважливіші мікробіологічні процеси, збудники яких є мікроорганізми
Найважливіші мікробіологічні процеси, збудники яких є мікроорганізми Ароматические кислоты и их соли
Ароматические кислоты и их соли Губна помада та ії призначення
Губна помада та ії призначення Кислород
Кислород Электронный помощник по химии (8 класс)
Электронный помощник по химии (8 класс) Бензо́л (C6H6, PhH)
Бензо́л (C6H6, PhH) Основные физико-химические свойства нефти и нефтепродуктов
Основные физико-химические свойства нефти и нефтепродуктов Мыло. Синтетические моющие средства
Мыло. Синтетические моющие средства Получение и собирание газов. Практическая работа
Получение и собирание газов. Практическая работа Оксиды
Оксиды Зелёная химия
Зелёная химия Изменение активности катализатора в процессе эксплуатации
Изменение активности катализатора в процессе эксплуатации Химические формулы. 8 класс
Химические формулы. 8 класс Амінокислоти. Склад і будова молекул, загальні та структурні формули, систематична номенклатура
Амінокислоти. Склад і будова молекул, загальні та структурні формули, систематична номенклатура Химические формулы
Химические формулы Бензин. Производство бензина
Бензин. Производство бензина Непредельные углеводороды. Этиленовые углеводороды (алкены)
Непредельные углеводороды. Этиленовые углеводороды (алкены) Природні джерела вуглеводнів і їх переробка
Природні джерела вуглеводнів і їх переробка Природные источники углеводородов
Природные источники углеводородов Periodic Table and Trends
Periodic Table and Trends Строение и свойства железоуглеродистых сплавов. (4)
Строение и свойства железоуглеродистых сплавов. (4) Химия и производство
Химия и производство Titration and Acid-Base Neutralization
Titration and Acid-Base Neutralization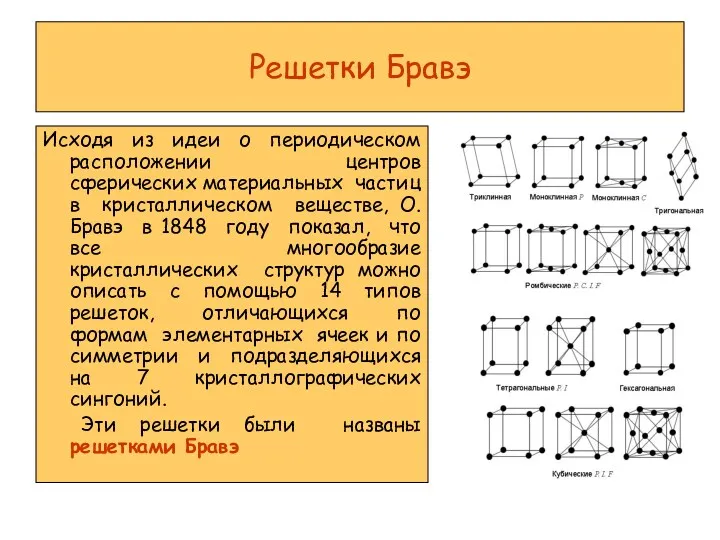 Решетки Бравэ
Решетки Бравэ