Содержание
- 2. ОКСИДЫ – это сложные вещества, состоящие из 2-х элементов, один из которых кислород. CaO – оксид
- 3. ИЗ ПРИВЕДЕННЫХ ФОРМУЛ ВЕЩЕСТВ ВЫБЕРИТЕ ФОРМУЛЫ ОКСИДОВ И НАЗОВИТЕ ИХ: H2S, Na2O, HCl, ZnO, CH4, Al2O3,
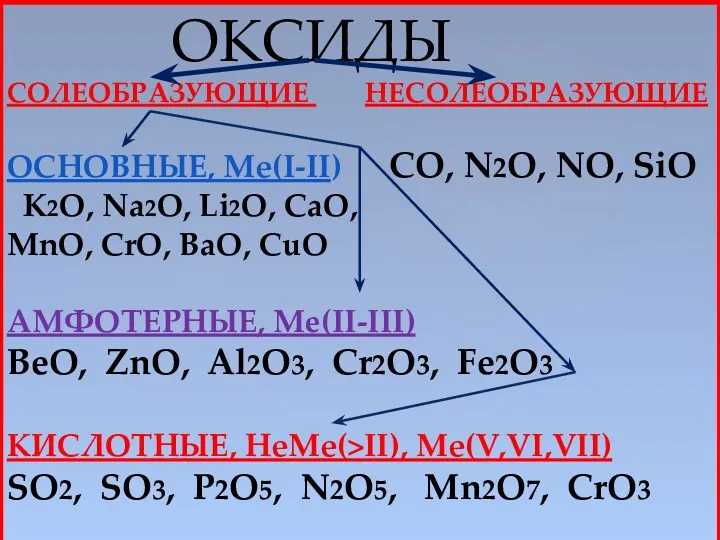
- 4. ОКСИДЫ СОЛЕОБРАЗУЮЩИЕ НЕСОЛЕОБРАЗУЮЩИЕ ОСНОВНЫЕ, Mе(I-II) CO, N2O, NO, SiO K2O, Na2O, Li2O, CaO, MnO, CrO, BaO,
- 5. ОСНОВНЫЕ ОКСИДЫ- ЭТО ТАКИЕ ОКСИДЫ, КОТОРЫМ СООТВЕТСТВУЮТ ГИДРОКСИДЫ -ОСНОВАНИЯ. (Образованы металлами с валентностью I-II) Li2O –LiOH
- 6. КИСЛОТНЫЕ ОКСИДЫ ЭТО ТАКИЕ ОКСИДЫ, КОТОРЫМ СООТВЕТСТВУЮТ ГИДРОКСИДЫ – КИСЛОТЫ CO2 - H2CO3 угольная к-та SO2
- 7. Выберите из приведенных формул несолеобразующие оксиды: Na2O, CuO, NO, CO2, N2O, SO3, CO, MgO, SiO Выберите
- 8. ФИЗИЧЕСКИЕ свойства оксидов ТВЕРДЫЕ CuO - черного цвета, Fe2O3-бурого цв. HgO - оранжевого цвета СaO, ZnO,
- 9. ПОЛУЧЕНИЕ ОКСИДОВ 1.Горение простых и сложных веществ: 2Mg + O2 = 2MgO 4Li + O2 =
- 10. РАЗЛОЖЕНИЕ СЛОЖНЫХ ВЕЩЕСТВ 1.Нерастворимых оснований Cu(OH)2 = CuO + H2O 2.Кислот H2SO3= SO2 + H2O 3.Солей
- 11. ДОМАШНЕЕ ЗАДАНИЕ §40 (до химических свойств), стр.135, №1, 2(а- д), 3 тесты 1, 2, 3, 5(подробно)
- 12. Распределите оксиды по свойствам N20, CaO, N2O5, Al2O3, SO2, V2O5, CO, BaO, CO2, NO, Fe2O3, ZnO,
- 13. H2SO4 угольная к-та HNO3 сернистая к-та H3PO4 азотная к-та HNO2 фосфорная к-та H2CO3 серная к-та H2SO3
- 14. 1.При окислении атмосферного азота образуется оксид азота (II). 2.При горении железа в кислороде образуется железная окалина
- 15. 5.Металлы, проявляющие переменную валентность, при непосредственном взаимодействии с кислородом обычно проявляют валентность =II. Составить уравнения реакций
- 16. ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВНЫЕ ОКСИДЫ 1.Оксиды Li, Na, K, Cs, Rb, Ca, Ba, Sr взаимодействуют с водой,
- 17. 2.С кислотами, образуя соли BaO + 2HCl = BaCl2 + H2O CuO + H2SO4 = CuSO4
- 18. Кислотные оксиды 1.Со щелочами, образуя соли CO2 + Ca(OH)2 = CaCO3↓ + H2O SO2 + 2NaOH
- 19. 2.С ВОДОЙ, образуя кислоты SO2 + H2O = H2SO3 SO3 + H2O = H2SO4 P2O5 +
- 20. 3.Основные и кислотные оксиды взаимодействуют между собой, образуя соли CaO + CO2 = CaCO3 MgO +
- 21. Я знаю, что Оксиды бывают…… Основным оксидам соответствуют… Кислотным оксидам соответствуют… Оксиды получают при горении…. Разложении…
- 22. 1.Составьте уравнения реакций взаимодействия с водой: оксида натрия, оксида бария, оксида цезия, оксида стронция. 2.Составьте уравнения
- 24. Скачать презентацию




















 Генетическая связь органических и неорганических соединений
Генетическая связь органических и неорганических соединений Кремний. Основные минералы кремния
Кремний. Основные минералы кремния Закон постоянства состава. Молекулярная формула вещества
Закон постоянства состава. Молекулярная формула вещества Первичная переработка нефти
Первичная переработка нефти Оксид серы (IV). Сернистая кислота и её соли
Оксид серы (IV). Сернистая кислота и её соли Типы химических реакций на примере свойств воды
Типы химических реакций на примере свойств воды Алканы. Способы получения алканов. Химические свойства алканов
Алканы. Способы получения алканов. Химические свойства алканов Електроліти в сучасних акумуляторах
Електроліти в сучасних акумуляторах Электронные конфигурации атомов
Электронные конфигурации атомов Нефть. Свойства нефти
Нефть. Свойства нефти Строение атома углерода
Строение атома углерода Катализ. Классификация каталитических процессов. Механизм действия катализаторов
Катализ. Классификация каталитических процессов. Механизм действия катализаторов Минеральные вяжущие вещества, материалы и изделия на их основе
Минеральные вяжущие вещества, материалы и изделия на их основе Применение серной кислоты
Применение серной кислоты Гигиена питания школьников
Гигиена питания школьников Классы неорганических веществ. Соли
Классы неорганических веществ. Соли Жасыл химия
Жасыл химия Стратегия химической промышленности
Стратегия химической промышленности Коррозия металлов
Коррозия металлов XXI ғасыр көшбасшысы
XXI ғасыр көшбасшысы Nuclear Energy, Controlled Fission and Fusion 2016
Nuclear Energy, Controlled Fission and Fusion 2016 20230416_urok_na_20.02.2023
20230416_urok_na_20.02.2023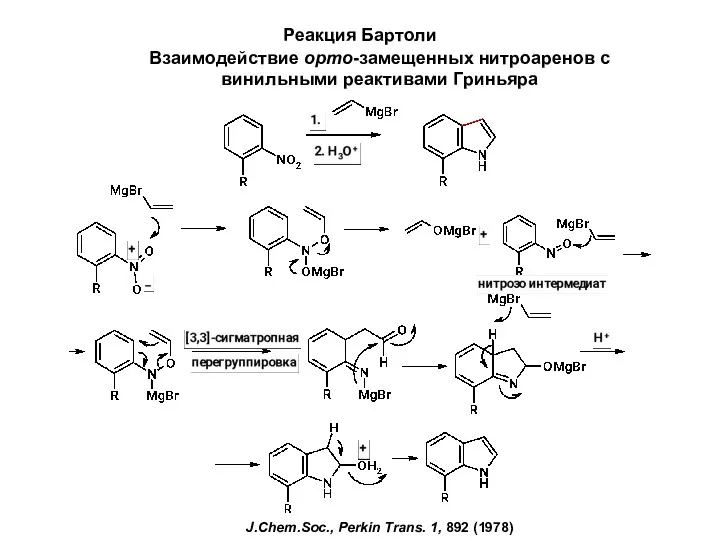 Реакция Бартоли. Взаимодействие орто-замещенных нитроаренов с винильными реактивами Гриньяра
Реакция Бартоли. Взаимодействие орто-замещенных нитроаренов с винильными реактивами Гриньяра Практикум по органической и биоорганической химии
Практикум по органической и биоорганической химии Методы в химии
Методы в химии Синтетические органические вещества
Синтетические органические вещества Качественные реакции на органические вещества
Качественные реакции на органические вещества Жиры
Жиры