Содержание
- 2. Характеристика по ПСХЭ 1.Положение в ПСХЭ. 4 группа, главная подгруппа, 3 период.3 ряд Аr=28 степень окисления:
- 3. Z=+14 +1р=14 0n=28-14=14 е=14 +14)2)8 )4 2 2 6 2 2 1S 2S 2P 3S 3P
- 4. Кремний является третьим (после кислорода и водорода) по распространен-ности элементом: на его долю приходиться 16,7 %
- 5. Основные минералы кремния Al2O3*2SiO2*2H2O –Белая глина K2O*Al2O3*SiO2 – полевой шпат K2O*Al2O3*6SiO2*H2O – слюда SiO2-кремнезем или речной
- 6. Кремний- главный элемент в царстве минералов и горных пород. Чаще всего он встречается в виде минералов
- 7. Некоторые морские организмы накапливают кремний в больших количествах. К богатым им морским растениям относят диатомовые водоросли,
- 8. а. в промышленности - восстановление углем в электрических печах SiO2+2С=Si+2CO↑ б. в лаборатории - восстановление металлами
- 9. 1)аморфный кремний –бурый порошок t плавления 1420 С. 2)кристаллический кремний - твердое вещество, темно-серого цвета со
- 10. а)взаимодействие с простыми веществами. Si-восстановитель 1) с галогенами Si+2F2 =SF4 - фторид кремния 2) с кислородом
- 11. Si-окислитель 5)с металлами Si+ 2Mg=t Mg2 Si -силицид магния Непосредственно с водородом кремний не реагирует. SiH4
- 12. б)взаимодействие со сложными веществами 1) из галогеноводородов реакция идет только с HF Si+4HF=SiF4+2H2↑ 2)из кислот реакция
- 13. Открытие. В 1834 году русский химик Гесс дал этому элементу русское название. Кремний был открыт в
- 14. Применение Применяется в технике для получения полупроводниковых материалов и сплавов. Так же для получения стекла и
- 15. Оксид кремния (IV) или кремнезём 1. Строение: Оксид кремния (IV) имеет не молекулярную ( как у
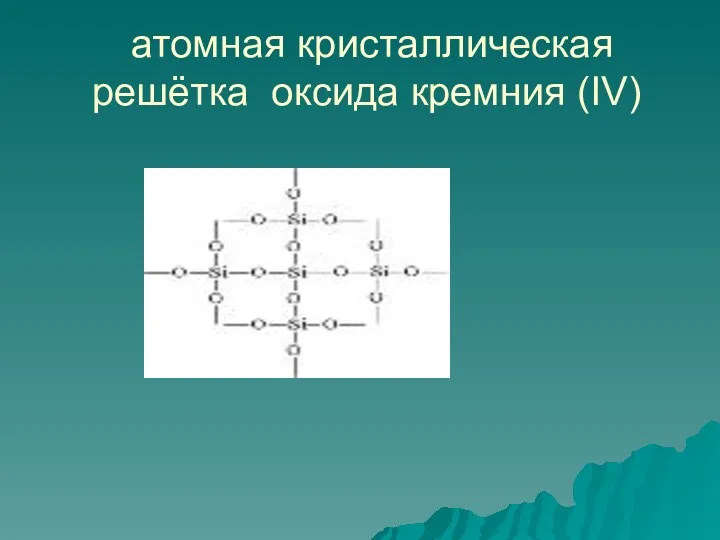
- 16. атомная кристаллическая решётка оксида кремния (IV)
- 17. Нахождение в природе.
- 18. Горный хрусталь
- 19. аметист
- 20. топаз
- 21. Авантюрин – один из видов кварца
- 22. Агат – камень художников
- 23. камея
- 24. Цитрин- кварц лимонного цвета
- 26. сапфирин – голубой агат
- 27. яшма
- 28. Силикатная промышленность 1. керамика 2.стекло 3. цемент
- 29. керамика А) строительная керамика Б) предметы быта 1. глиняная посуда 2. Фарфор 3. фаянс
- 30. Глиняная посуда
- 31. фарфор
- 32. фаянс
- 33. стекло
- 35. Скачать презентацию






























 Приёмы обращения с лабораторным оборудованием
Приёмы обращения с лабораторным оборудованием Химия биогенных элементов p -блока
Химия биогенных элементов p -блока Периодический закон и периодическая система химических элементов
Периодический закон и периодическая система химических элементов Основные классы неорганических веществ. Соединения химических элементов
Основные классы неорганических веществ. Соединения химических элементов Выделение транс-анетола из эфирных масел
Выделение транс-анетола из эфирных масел Изучение свойств горных пород, минералов и полезных ископаемых
Изучение свойств горных пород, минералов и полезных ископаемых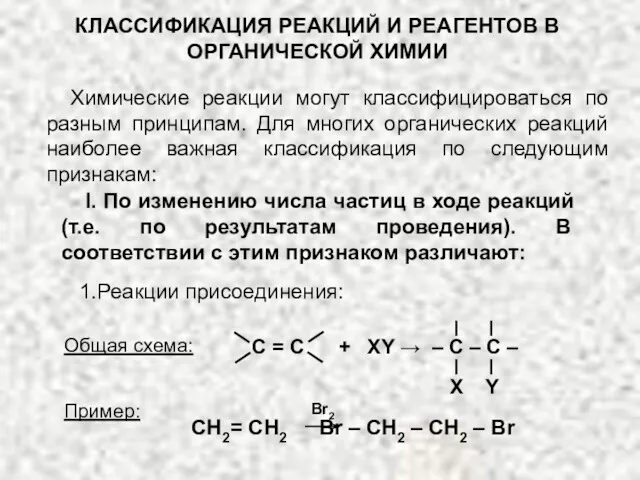 Классификация реакций и реагентов органической химии
Классификация реакций и реагентов органической химии Химическая промышленность
Химическая промышленность Азотсодержащие гетероциклические соединения
Азотсодержащие гетероциклические соединения Химические свойства металлов
Химические свойства металлов Хімічний склад і використання мінералів
Хімічний склад і використання мінералів Химиялық тепе-теңдік және оның ығысуына әсер етуші жағдайлар. Ле Шателье-Браун принциптері
Химиялық тепе-теңдік және оның ығысуына әсер етуші жағдайлар. Ле Шателье-Браун принциптері Окислительно-восстановительные реакции. Лекция 8
Окислительно-восстановительные реакции. Лекция 8 Получение порошков автоклавным осаждением
Получение порошков автоклавным осаждением Обратимость химических реакций. Химическое равновесие и способы его смещения
Обратимость химических реакций. Химическое равновесие и способы его смещения Строение атома
Строение атома Электролиз. Электролизеры
Электролиз. Электролизеры Применение уксусной кислоты
Применение уксусной кислоты Фосфор. Гипофосфатемия и гиперфосфатемия
Фосфор. Гипофосфатемия и гиперфосфатемия Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Розрахунки за хімічними рівняннями
Розрахунки за хімічними рівняннями Установка по переработке углеводородов
Установка по переработке углеводородов Комплексные соединения
Комплексные соединения Физико-химические методы анализа. Лекция 3
Физико-химические методы анализа. Лекция 3 Сера. Аллотропные модификации
Сера. Аллотропные модификации Гидролиз органических и неорганических соединений
Гидролиз органических и неорганических соединений Качественное определение химических элементов в почве
Качественное определение химических элементов в почве Аммиак
Аммиак