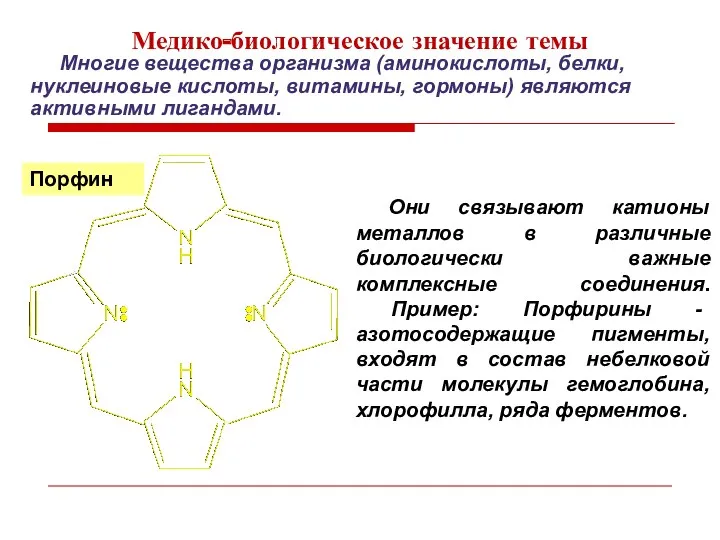
Содержание
- 2. Они связывают катионы металлов в различные биологически важные комплексные соединения. Пример: Порфирины - азотосодержащие пигменты, входят
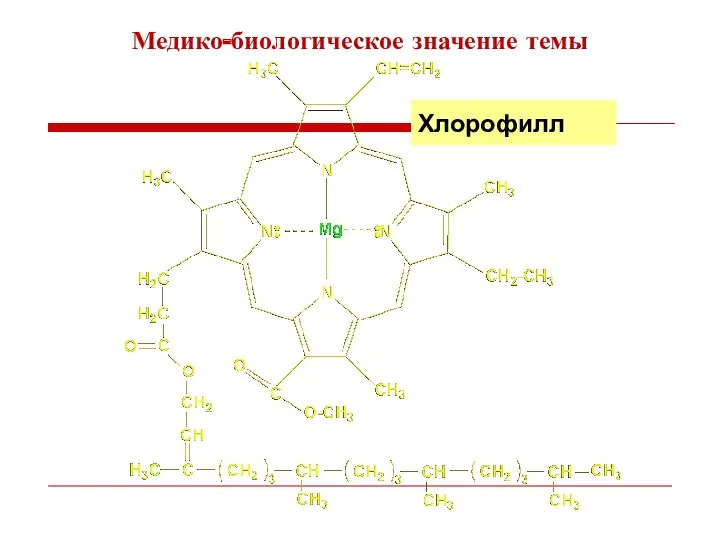
- 3. Хлорофилл Медико-биологическое значение темы
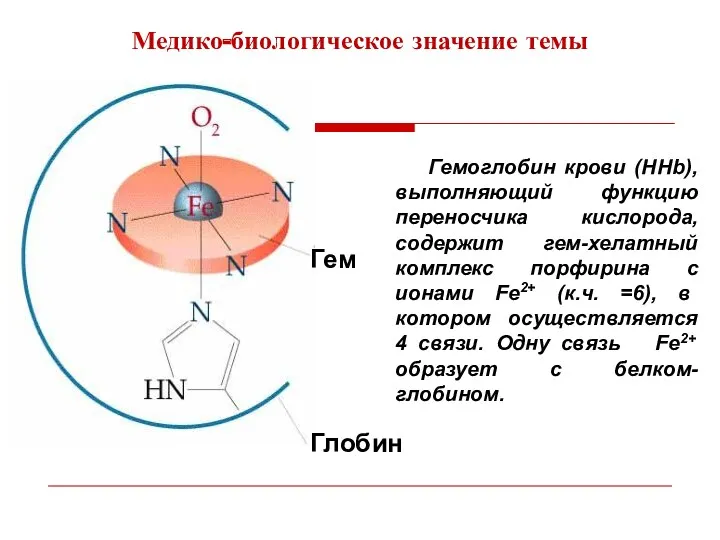
- 4. Гемоглобин крови (HHb), выполняющий функцию переносчика кислорода, содержит гем-хелатный комплекс порфирина с ионами Fe2+ (к.ч. =6),
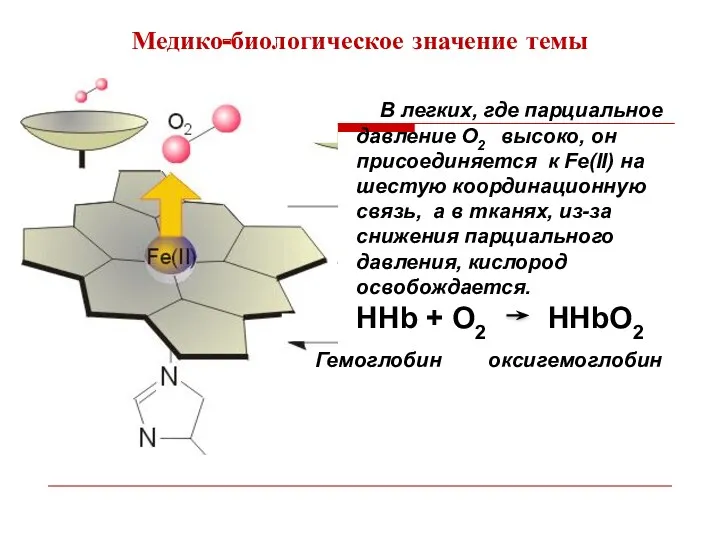
- 5. В легких, где парциальное давление O2 высоко, он присоединяется к Fe(II) на шестую координационную связь, а
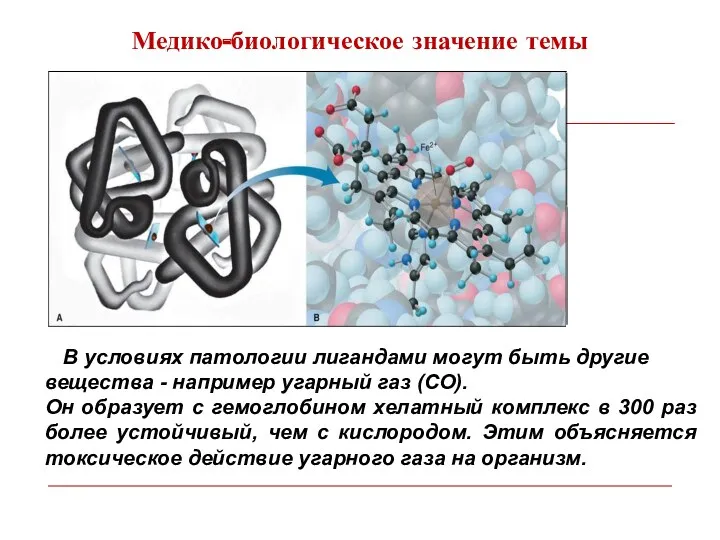
- 6. Медико-биологическое значение темы В условиях патологии лигандами могут быть другие вещества - например угарный газ (CO).
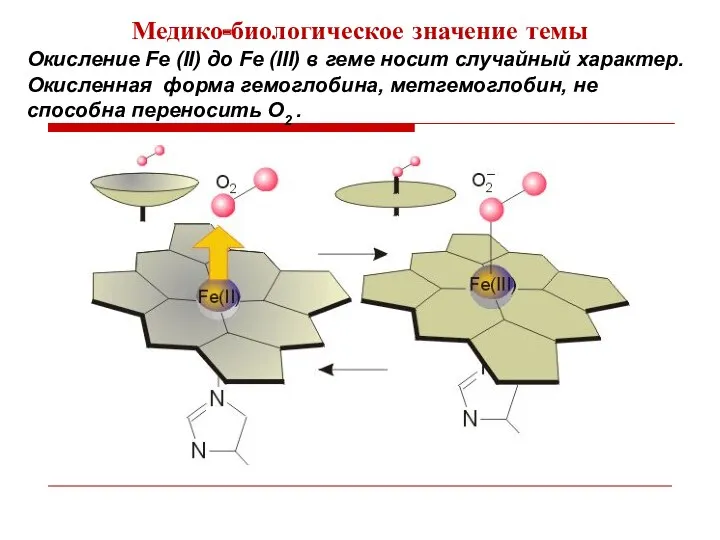
- 7. Медико-биологическое значение темы Окисление Fe (II) до Fe (III) в геме носит случайный характер. Окисленная форма
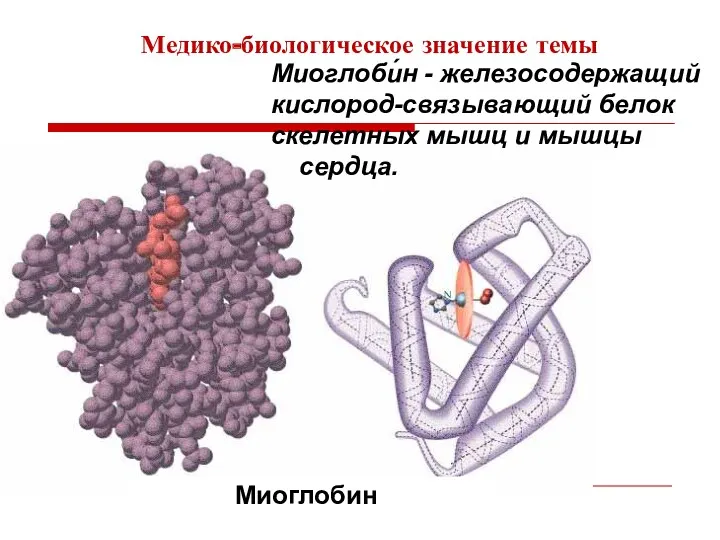
- 8. Миоглобин Миоглоби́н - железосодержащий кислород-связывающий белок скелетных мышц и мышцы сердца. Медико-биологическое значение темы
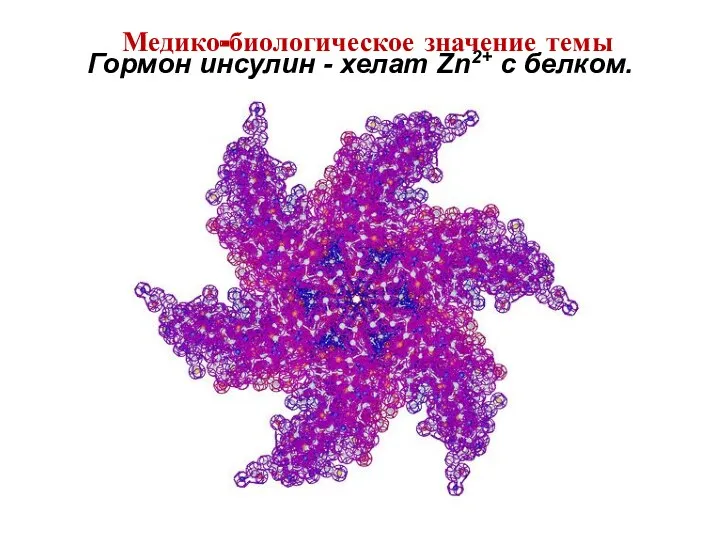
- 9. Гормон инсулин - хелат Zn2+ c белком. Медико-биологическое значение темы
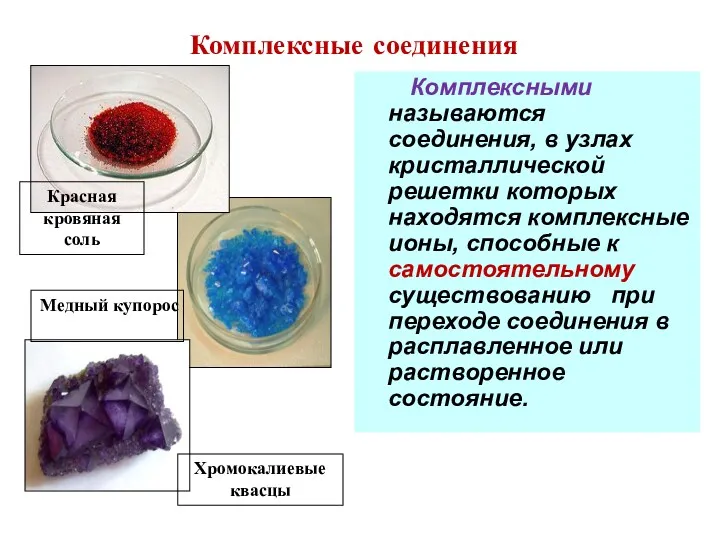
- 10. Комплексные соединения Комплексными называются соединения, в узлах кристаллической решетки которых находятся комплексные ионы, способные к самостоятельному
- 11. Координационная теория А. Вернера (1893 г. ) "Меня часто охватывает экстаз пред красотой моей науки. Чем
- 12. Строение комплексных соединений K3[Fe(CN)6] Ион- Комплексо- образователь Лиганды Координационное число Внутренняя сфера Внешняя сфера [Cu(NH3)4]Cl2 Внутренняя
- 13. [Co(NH3)6]3+ - комплекс [Co(NH3)6]Cl3 – комплексное соединение Комплекс - центральный атом или ион (чаще всего металла),
- 14. Комплексообразователями являются атомы или ионы металлов, имеющие свободные орбитали (чаще металлы d-элементы Co3+, Cu2+, Cu+, Fe3+,
- 15. Лиганды (от лат. ligo – привязываю) имеют неподеленные электронные пары, т.е. являются донорами электронов(или адденами) -
- 16. Анионы бескислородных кислот F-, Cl-, Br-, I- (фторо-лиганд и т.д.) Остатки кислородсодержащих кислот CH3COO- - ацетато-лиганд
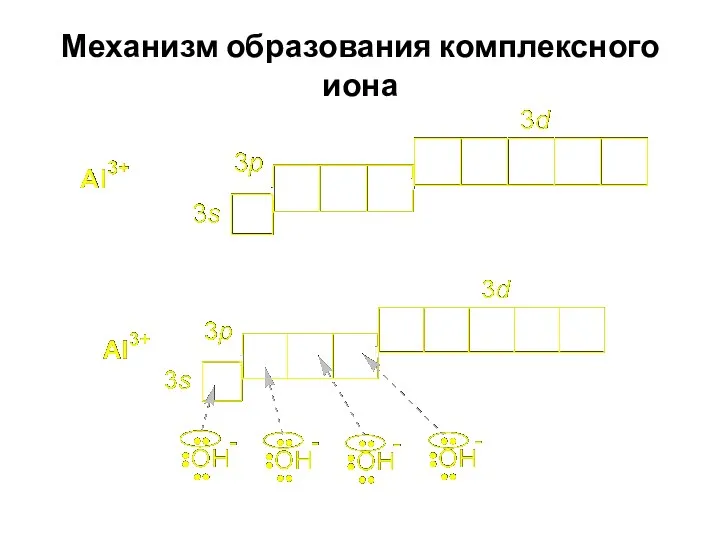
- 17. Механизм комплексообразования связан с межионным, межмолекулярным взаимодействиями, но основной вклад в образование внутренней сферы вносит донорно-акцепторное
- 18. Механизм образования комплексного иона
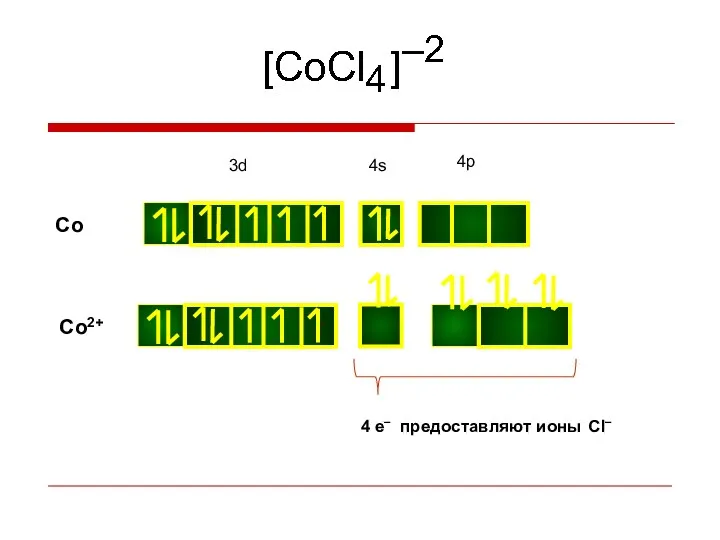
- 19. Co Co2+ 4 e– предоставляют ионы Cl–
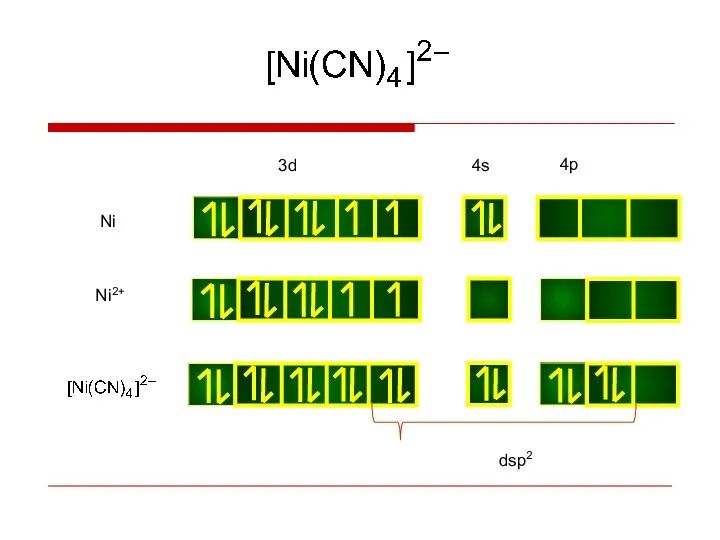
- 20. Ni Ni2+ dsp2
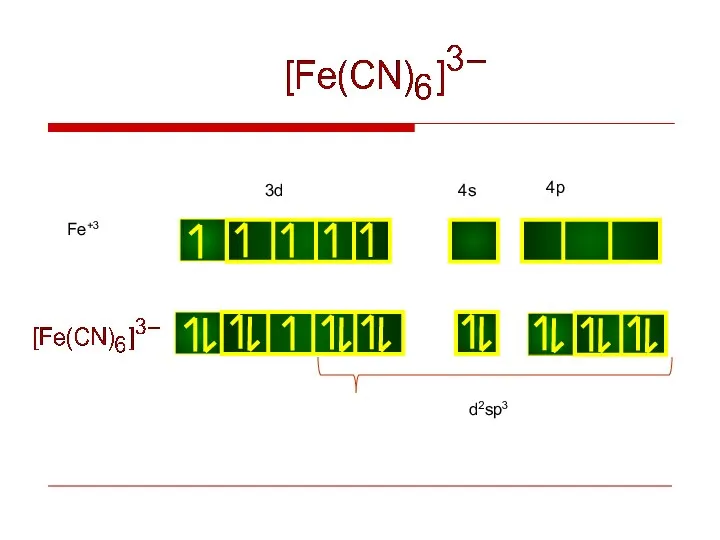
- 21. Fe+3 d2sp3
- 22. Координационное число (к. ч.) комплексообразователя показывает, сколько связей образует комплексообразователь с лигандами. Величина к.ч. зависит от
- 23. Координационные числа наиболее распространенных комплексообразователей:
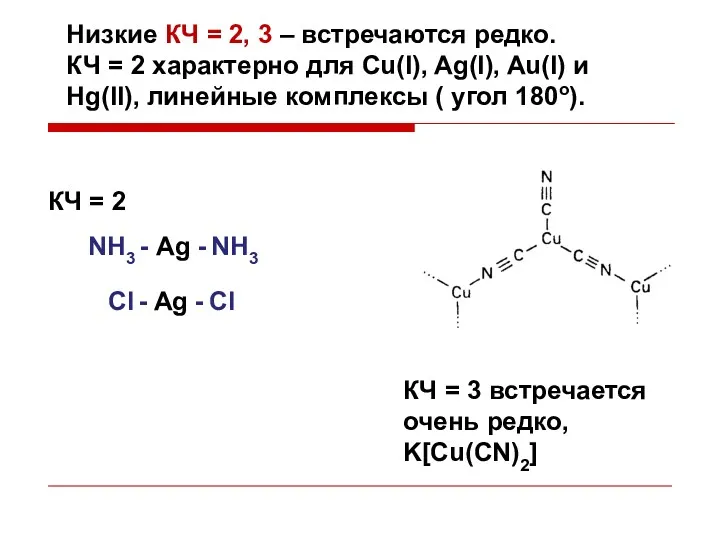
- 24. Низкие КЧ = 2, 3 – встречаются редко. КЧ = 2 характерно для Cu(I), Ag(I), Au(I)
- 25. Квадратный комплекс [Pt2+(NH3)2Cl2] КЧ = 4 (тетраэдр и плоский квадрат) [Ni(CO)4] 2+ Тетраэдр
- 26. КЧ = 5 – менее распространено (квадратная пирамида и тригональная бипирамида). Пентацианоникелят (II), [Ni(CN)5]3-
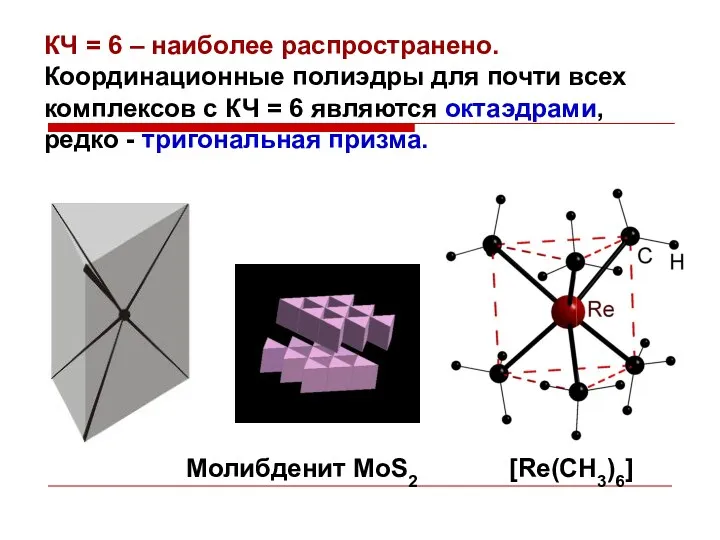
- 27. КЧ = 6 – наиболее распространено. Координационные полиэдры для почти всех комплексов с КЧ = 6
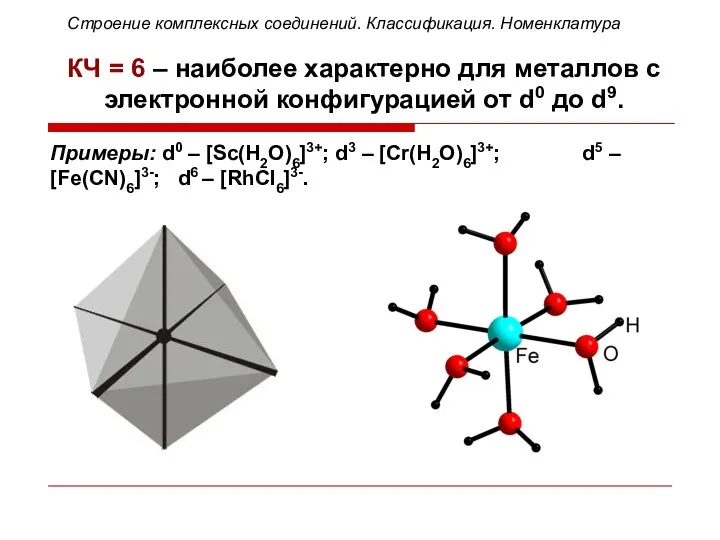
- 28. КЧ = 6 – наиболее характерно для металлов с электронной конфигурацией от d0 до d9. Примеры:
- 29. Заряд внутренней сферы комплексного соединения Z равен алгебраической сумме зарядов комплексообразователя и лигандов.
- 30. Пример: Комплексообразователь – Со3+ Лиганды- Сl- , Н2О КЧ (Со3+) = 6 [Со3+ (Сl- )4(Н2О)2]- Z=1
- 31. Классификация и номенклатура комплексных соединений По характеру заряда внутренней сферы различают катионные, анионные и нейтральные комплексы.
- 32. Число лигандов – греч. числит. 1 – (моно) 2 – ди 3 – три 4 –
- 33. Номенклатура катионных комплексов Греческим числительным называют число лигандов: 1-моно, 2-ди, 3-три, 4-тетра, 5-пента, 6-гекса; Называют лиганды:
- 34. Примеры: [Cu(NH3)4]Cl2 - хлорид тетраамминмеди(II); [AgI(NH3)2]OH – гидроксид диамминсеребра(I); [CoIII(NH3)6]Cl3 – хлорид гексаамминкобальта(III) I I H2O
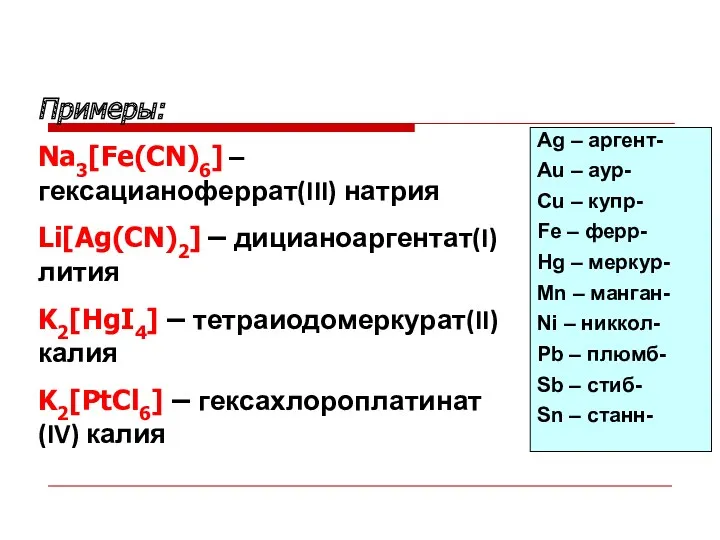
- 35. Номенклатура анионных комплексов Греческим числительным называют число лигандов. Называют лиганды. Называют комплексообразователь латинским наименованием с окончанием
- 36. Ag – аргент- Au – аур- Cu – купр- Fe – ферр- Hg – меркур- Mn
- 37. Номенклатура нейтральных комплексов Греческим числительным называют число лигандов. Называют лиганды. Называют комплексообразователь русским наименованием. Валентность комплексообразователя
- 38. Примеры: [Ni(CO)4] – тетракарбонилникель; [Co2(CO)8] – октакарбонилдикобальт; [Al2Cl6] – гексахлородиалюминий; [CoIIICl3(NH3)3] – триамминтрихлорокобальт; [CoII (NO2)2(H2O)4] –
- 39. Устойчивость комплексных соединений Различают первичную и вторичную диссоциацию комплексных соединений. а) Первичная диссоциация – это диссоциация
- 40. [Ag(NH3)2]+ [Ag(NH3)]+ + NH3 [Ag(NH3)]+ Ag+ + NH3 [Ag(NH3)2]+ Ag+ + 2NH3 Она протекает незначительно. б)
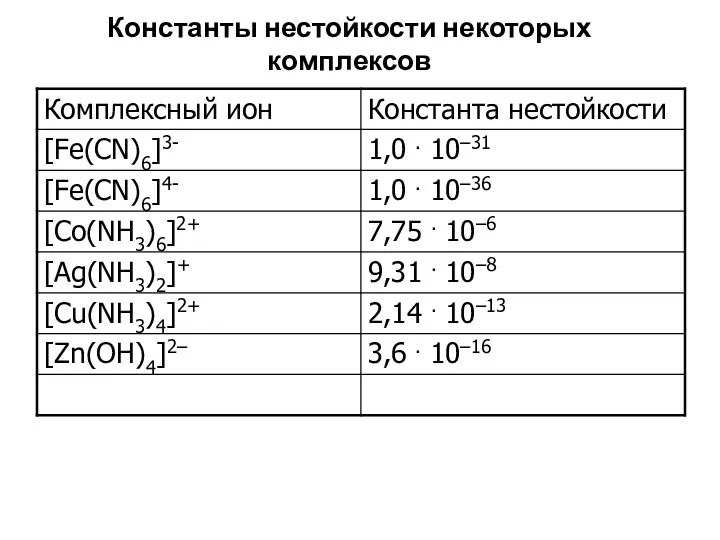
- 41. Устойчивость комплексных ионов характеризуется константой нестойкости (Кнест), которая определяется на основании закона действующих масс. [Ag+] [NH3]2
- 42. Константы нестойкости некоторых комплексов
- 43. Устойчивость комплексных соединений Константа нестойкости характеризует термодинамическую устойчивость комплекса, которая зависит от прочности связей между центральным
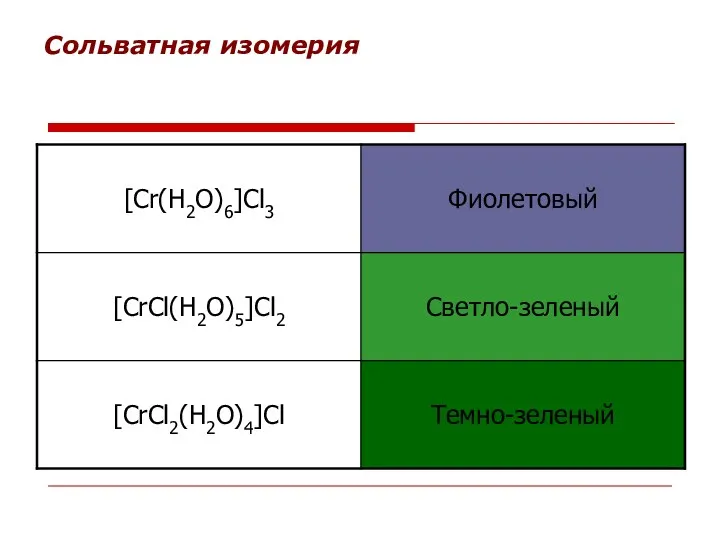
- 44. Изомерия комплексных соединений Для комплексных соединений характерны следующие виды изомерии: сольватная (в водных средах гидратная), ионизационная,
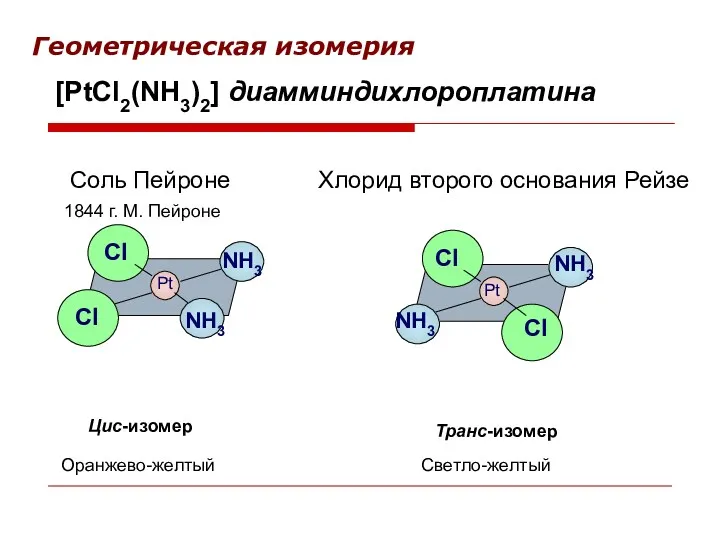
- 45. Геометрическая изомерия cis-[CoCl2(NH3)4]+ trans-[CoCl2(NH3)4]+
- 46. Геометрическая изомерия Pt Pt Cl Cl Cl Cl NH3 NH3 NH3 NH3 Соль Пейроне Хлорид второго
- 47. Сольватная изомерия
- 48. cis-[Co(En)2Cl2]+ Оптическая изомерия
- 49. Лиганды могут присоединяться к комплексообразователю посредством одного или нескольких атомов, т.е. лиганды обладают координационной емкостью -
- 50. Полидентатные лиганды присоединяются к комплексообразователю посредством нескольких атомов. Например: функциональные органические соединения. Большое практическое значение имеют
- 51. [Pt2+(Еn)4]2+ этилендиаминплатина (II)
- 52. [Co3+(Еn)4]3+ этилендиаминкобальт(II)
- 53. Для удобства координации молекулы полидентатных лигандов сворачиваются в циклы. В таких комплексах комплексообразователь зажат «клешней» лигандов.
- 55. Скачать презентацию

![Строение комплексных соединений K3[Fe(CN)6] Ион- Комплексо- образователь Лиганды Координационное число](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/327445/slide-11.jpg)
![[Co(NH3)6]3+ - комплекс [Co(NH3)6]Cl3 – комплексное соединение Комплекс - центральный](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/327445/slide-12.jpg)






![Квадратный комплекс [Pt2+(NH3)2Cl2] КЧ = 4 (тетраэдр и плоский квадрат) [Ni(CO)4] 2+ Тетраэдр](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/327445/slide-24.jpg)
![КЧ = 5 – менее распространено (квадратная пирамида и тригональная бипирамида). Пентацианоникелят (II), [Ni(CN)5]3-](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/327445/slide-25.jpg)





![Примеры: [Cu(NH3)4]Cl2 - хлорид тетраамминмеди(II); [AgI(NH3)2]OH – гидроксид диамминсеребра(I); [CoIII(NH3)6]Cl3](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/327445/slide-33.jpg)


![Примеры: [Ni(CO)4] – тетракарбонилникель; [Co2(CO)8] – октакарбонилдикобальт; [Al2Cl6] – гексахлородиалюминий;](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/327445/slide-37.jpg)

![[Ag(NH3)2]+ [Ag(NH3)]+ + NH3 [Ag(NH3)]+ Ag+ + NH3 [Ag(NH3)2]+ Ag+](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/327445/slide-39.jpg)



![Геометрическая изомерия cis-[CoCl2(NH3)4]+ trans-[CoCl2(NH3)4]+](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/327445/slide-44.jpg)
![cis-[Co(En)2Cl2]+ Оптическая изомерия](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/327445/slide-47.jpg)


![[Pt2+(Еn)4]2+ этилендиаминплатина (II)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/327445/slide-50.jpg)
![[Co3+(Еn)4]3+ этилендиаминкобальт(II)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/327445/slide-51.jpg)

 Растворы электролитов. Буферные растворы. Лекция 4
Растворы электролитов. Буферные растворы. Лекция 4 Гидроксиды. Основания. Состав, классификация, свойства, получение
Гидроксиды. Основания. Состав, классификация, свойства, получение Аналитическая химия. Качественный анализ
Аналитическая химия. Качественный анализ Бутадиеновые каучуки
Бутадиеновые каучуки Көпатомды спирттер. Химиялық қасиеттері
Көпатомды спирттер. Химиялық қасиеттері Задачи на растворы
Задачи на растворы Гідроліз солей
Гідроліз солей Полимерные материалы. Пластические массы и строительные материалы на их основе
Полимерные материалы. Пластические массы и строительные материалы на их основе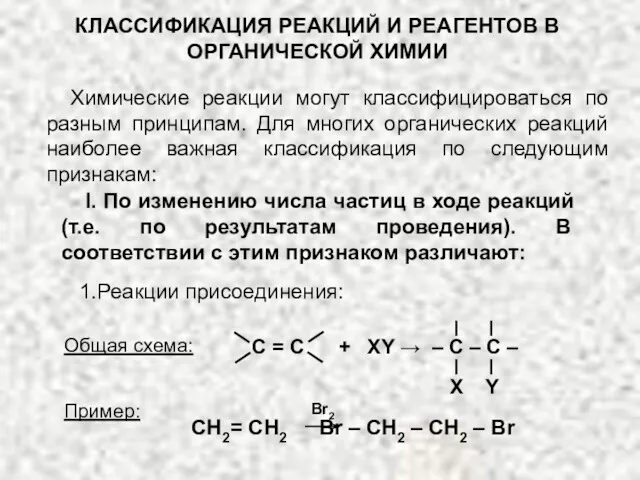 Классификация реакций и реагентов органической химии
Классификация реакций и реагентов органической химии Оксиди: поняття, склад і назви, фізичні властивості, поширеність у природі, використання
Оксиди: поняття, склад і назви, фізичні властивості, поширеність у природі, використання Дисперсные системы
Дисперсные системы Химический состав воздуха
Химический состав воздуха Массовая доля элемента в сложном веществе
Массовая доля элемента в сложном веществе Химическая связь
Химическая связь Физические и химические свойства воды
Физические и химические свойства воды Чистые вещества и смеси
Чистые вещества и смеси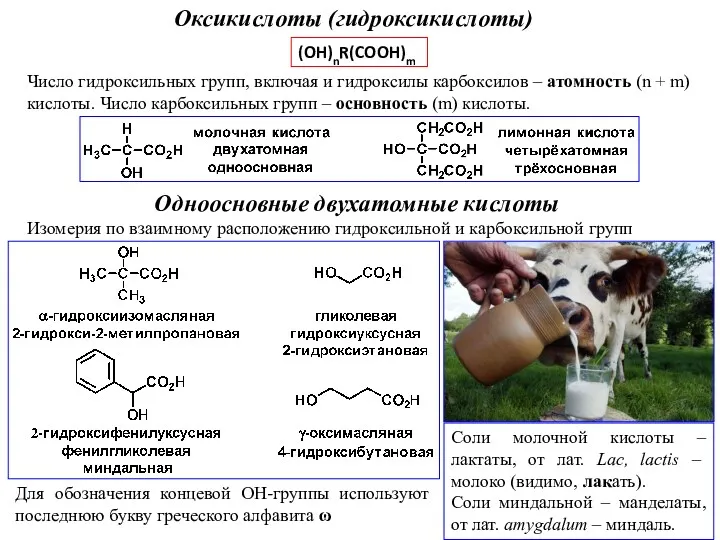 Оксикислоты (гидроксикислоты)
Оксикислоты (гидроксикислоты) Польза и вред химического производства
Польза и вред химического производства Химические свойства металлов
Химические свойства металлов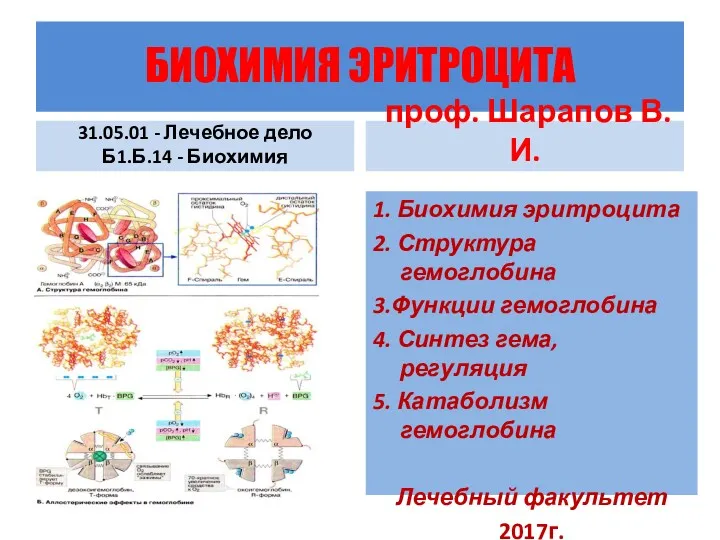 Биохимия эритроцита
Биохимия эритроцита Что такое хорошо и что такое плохо, Или правила игры от очень строгой химички
Что такое хорошо и что такое плохо, Или правила игры от очень строгой химички Растворы. Термодинамика образования растворов. Растворимость веществ (Лекция 3)
Растворы. Термодинамика образования растворов. Растворимость веществ (Лекция 3) Менделеевские уроки. День науки
Менделеевские уроки. День науки Хімічні явища у природі
Хімічні явища у природі Конденсация. Капельная и пленочная конденсация
Конденсация. Капельная и пленочная конденсация Лекция 6. Алициклические углеводороды (циклоалканы, нафтены)
Лекция 6. Алициклические углеводороды (циклоалканы, нафтены) Хроматографические методы анализа
Хроматографические методы анализа Сложные эфиры
Сложные эфиры