Содержание
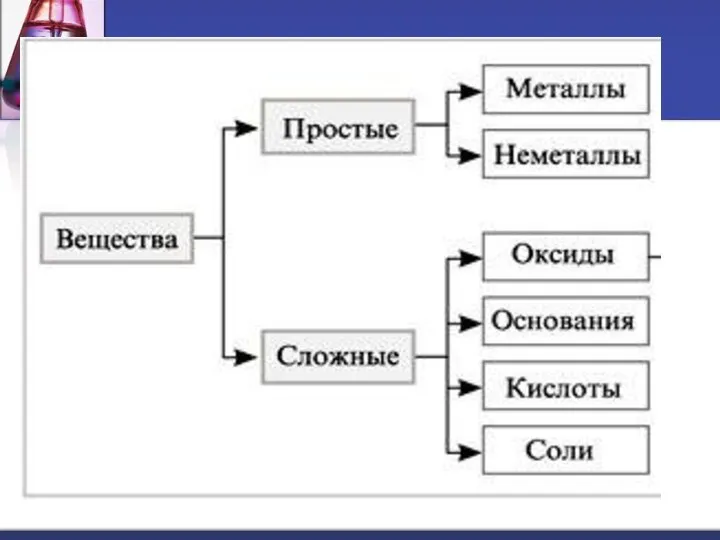
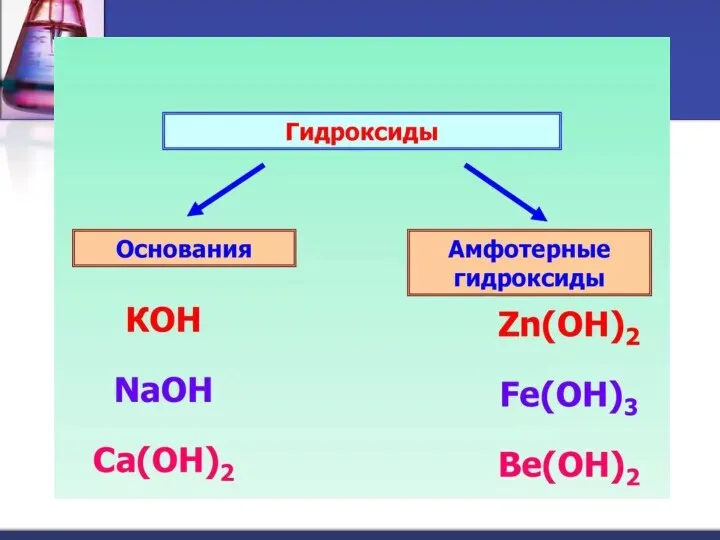
- 3. Гидроксиды – сложные вещества, состоящие из атомов металла, соединенных с одной или несколькими гидроксогруппами. ОН –
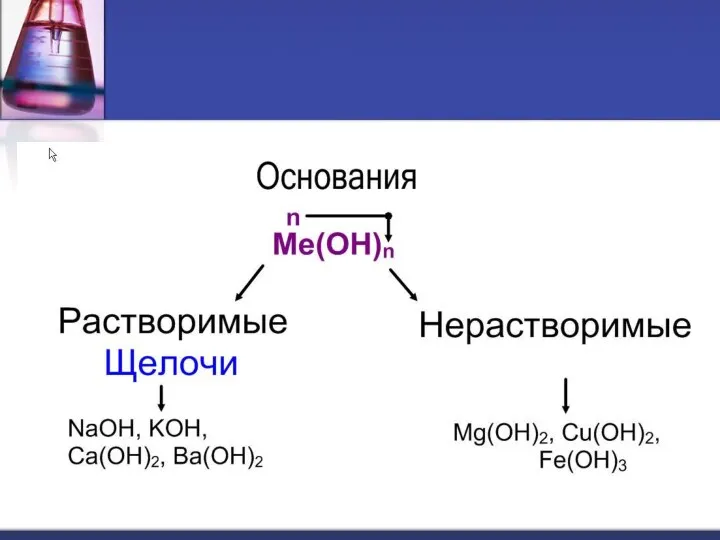
- 6. Щелочи образуют металлы, стоящие в IA и IIA группах (кроме Be и Mg) Периодической таблицы химических
- 7. Нерастворимые в воде основания образованы остальными металлами, которым соответствуют основные и амфотерные оксиды. Это твердые вещества,
- 8. Получение оснований Растворимых (щелочей) 1. Активный металл + вода = щелочь + водород 2Na + 2H2O
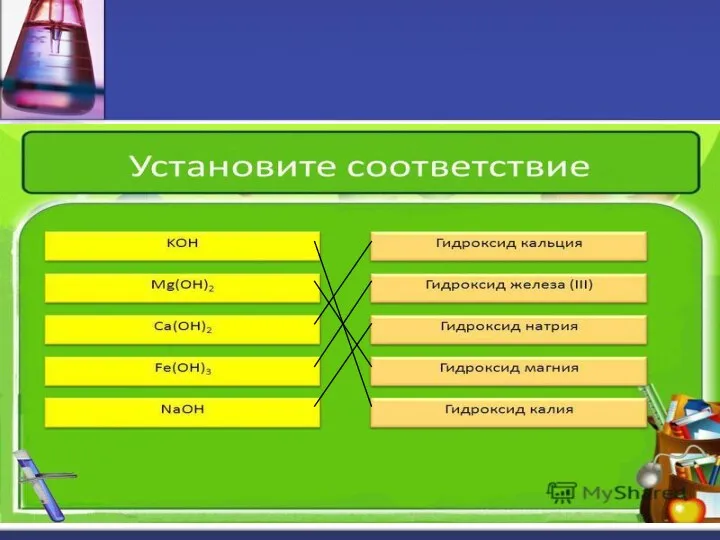
- 10. Напишите формулы оснований: а) гидроксид калия б) гидроксид марганца(II) в) гидроксид кальция г) гидроксид алюминия д)
- 11. Химические свойства
- 12. Реакция между двумя сложными веществами при которой они обмениваются своими составными частями называется реакцией обмена. Реакция
- 13. Химические свойства
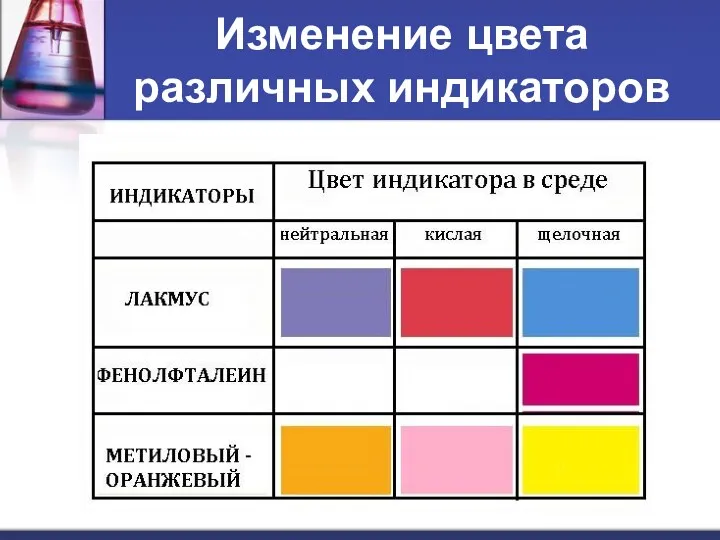
- 14. Изменение цвета различных индикаторов
- 16. Задание 1. Напишите уравнения реакций оснований с кислотами LiOH + H3PO4 → Ba(OH)2 + HNO3 →
- 18. Скачать презентацию










 Кремний, его физические и химические свойства
Кремний, его физические и химические свойства Генетическая связь между классами неорганических соединений
Генетическая связь между классами неорганических соединений Общие черты гидротермальных месторождений
Общие черты гидротермальных месторождений Коррозия каменных и бетонных строительных конструкций
Коррозия каменных и бетонных строительных конструкций Общая характеристика галогенов
Общая характеристика галогенов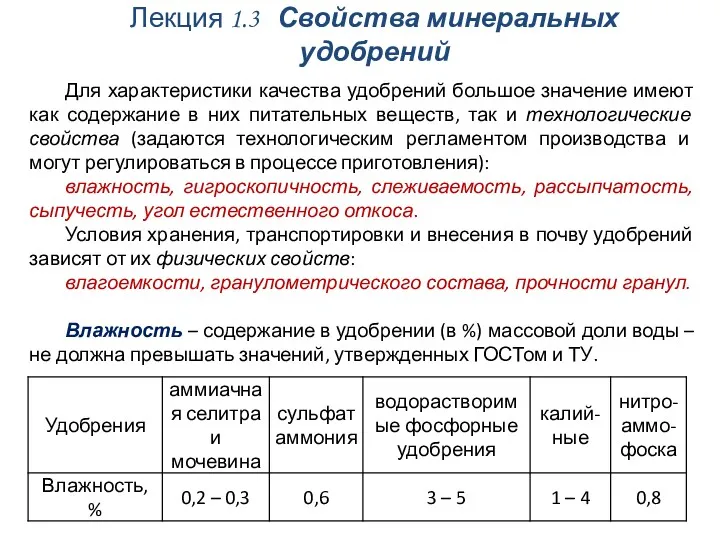 Свойства минеральных удобрений
Свойства минеральных удобрений 20231114_soli._klassifikatsiyasvoystva
20231114_soli._klassifikatsiyasvoystva Методика преподавания химии
Методика преподавания химии Разноцветные кристаллы
Разноцветные кристаллы Минералогия литофильных редких элементов. Бериллий
Минералогия литофильных редких элементов. Бериллий Disperse systems. True solution
Disperse systems. True solution Коррозия и защита материалов
Коррозия и защита материалов Электронная природа химической связи. Кристаллические и аморфные вещества
Электронная природа химической связи. Кристаллические и аморфные вещества Удивительный мир камня
Удивительный мир камня Химическое равновесие
Химическое равновесие Титан
Титан Роль химии в жизни человека
Роль химии в жизни человека Терминология и основные понятия в химии высокомолекулярных соеденений
Терминология и основные понятия в химии высокомолекулярных соеденений 5511c750430548bfa1da4ba840324bb2
5511c750430548bfa1da4ba840324bb2 Бензол. Физические и химические свойства
Бензол. Физические и химические свойства Получение и химические свойства оснований
Получение и химические свойства оснований Установка по переработке углеводородов
Установка по переработке углеводородов Полиметилметакрилат
Полиметилметакрилат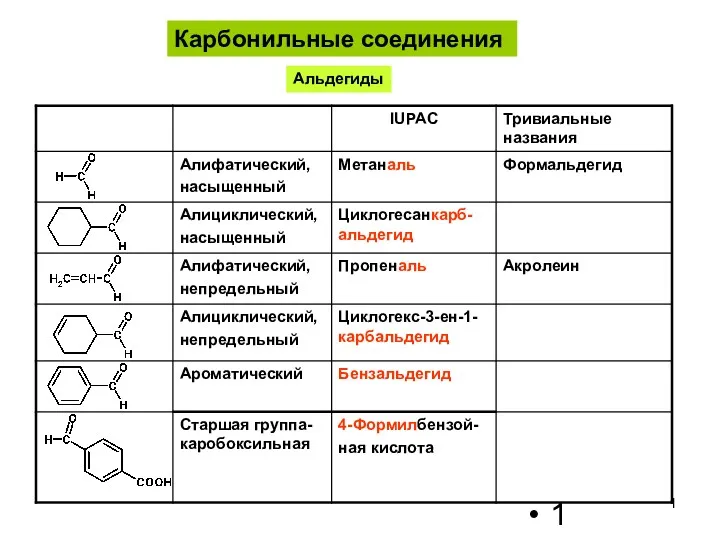 Карбонильные соединения. Альдегиды
Карбонильные соединения. Альдегиды Алкалоїди. Поняття алкалоїди і їх функції
Алкалоїди. Поняття алкалоїди і їх функції Основной государственный экзамен Химия 2021. Задание 5
Основной государственный экзамен Химия 2021. Задание 5 Учение о растворах. Фазовые равновесия
Учение о растворах. Фазовые равновесия Процессы и операции формообразования. Металлургия цветных металлов
Процессы и операции формообразования. Металлургия цветных металлов