Содержание
- 2. Энергия Гиббса реакции в нестандартных условиях С ≠С0 ΔrGi =ΔrG0i + R⋅T⋅lnCi ΔrG = (νc⋅ΔfG0C+ νd⋅ΔfG0D
- 3. 4.7 Равновесие – термодинамические условия (ΔrG = 0)
- 4. Константа равновесия К, её размерность. Связь между К (кинетич.) и стандартной К 0 (термодинам.) К≡KX -
- 5. Сдвиг равновесия Изобара реакции Р-const ΔrН0 ΔrН0>0 (эндотерм.реакция) – K0(T) возрастающая функция(↑Т, К0↑) Изотерма реакции T-const
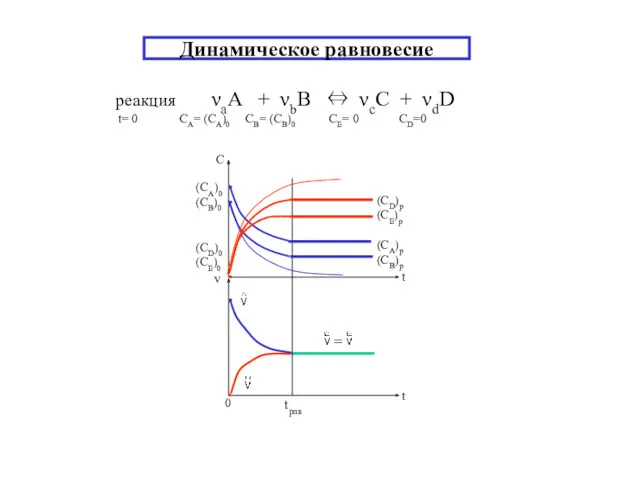
- 6. Динамическое равновесие реакция νаA + νbB ⇔ νсC + νdD t= 0 CA= (CA)0 CB= (CB)0
- 7. Расчет равновесного состава(концентраций) газовой смеси 1. Расчет К0(Т) Для определенной Т рассчитывают → ΔrG0(T)=ΔrH0(T) –Т·ΔrS0(T). Затем
- 8. Пример. Диссоциация АВ при Р -const и температуре Т АВ = А + В ni САВ-z
- 9. Равновесие в растворах(дисперсных системах)
- 10. Электролитическая диссоциация С0 - общая концентрация СД - конц.молекул в виде ионов α → 1 КД
- 11. Ионное произведение воды H2O ⇔ H+ + OH- Нейтральная среда [H+] = [OH–] = 10-7 [моль/л]
- 12. Водородный показатель pH = –lg[H+] Нейтральная среда pH = 7 Кислая среда pH Щелочная среда pH
- 13. Растворы кислот и оснований МеOH ⇔ Ме+ + OH- Слабые электролиты α → 0 Сильные электролиты
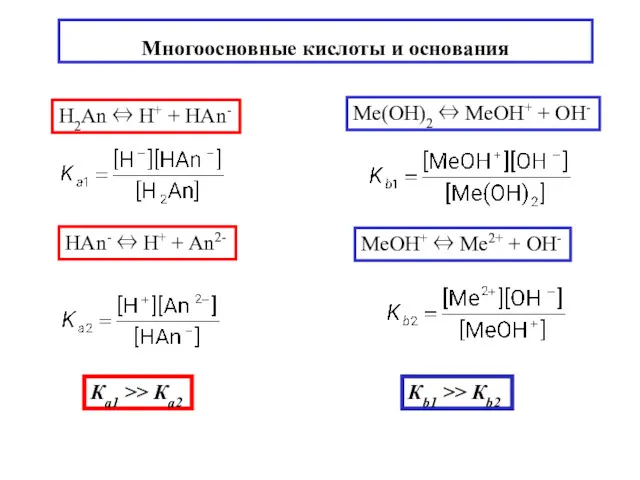
- 14. Многоосновные кислоты и основания H2An ⇔ H+ + НAn- HAn- ⇔ H+ + An2- Ка1 >>
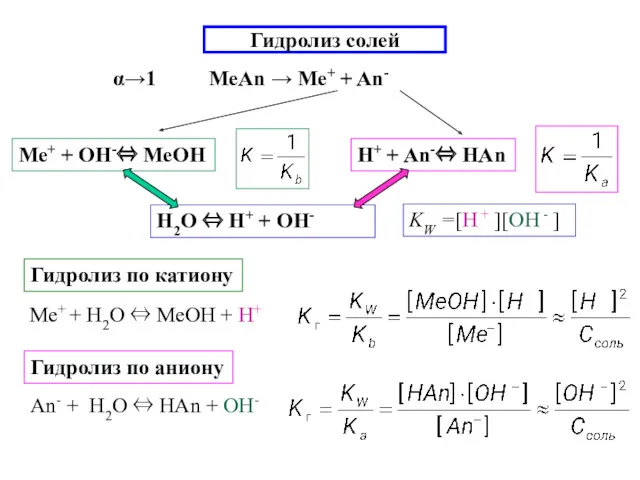
- 15. Гидролиз солей α→1 МеAn → Ме+ + An- Гидролиз по катиону Гидролиз по аниону
- 16. Примеры гидролиза солей 1) Kb→0; Ka→ ∞ CuSO4 → Cu2+ + SO42- 2 CuSO4+ 2 H2O
- 17. Произведение растворимости - ПР S-растворимость осадка[моль/л] [Kat+] = x·S [моль/л]
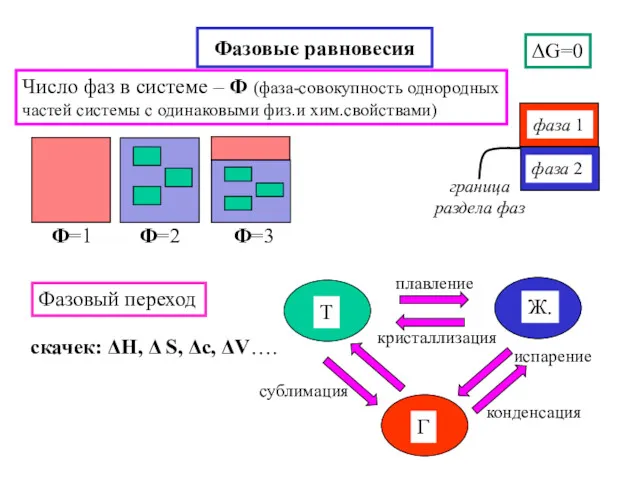
- 18. Фазовые равновесия ΔG=0 Фазовый переход скачек: ΔH, Δ S, Δc, ΔV…. Число фаз в системе –
- 19. Число компонентов – К (независимые составные части системы) Число видов молекул, необходимое и достаточное для образования
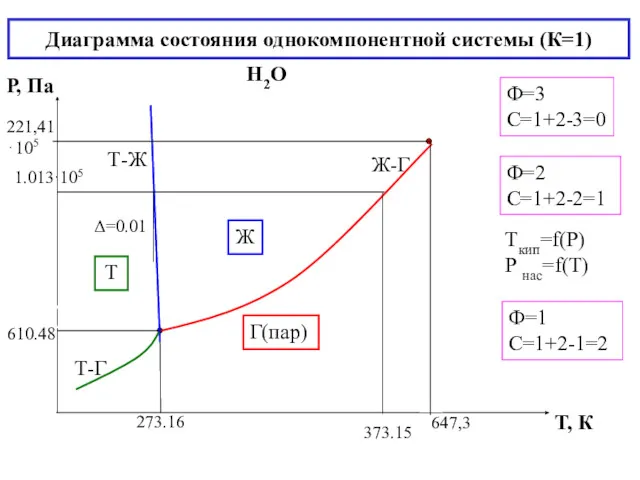
- 20. Диаграмма состояния однокомпонентной системы (К=1) Н2О Ф=2 С=1+2-2=1 Ф=3 С=1+2-3=0 Ф=1 С=1+2-1=2 Ж Г(пар) Т Tкип=f(Р)
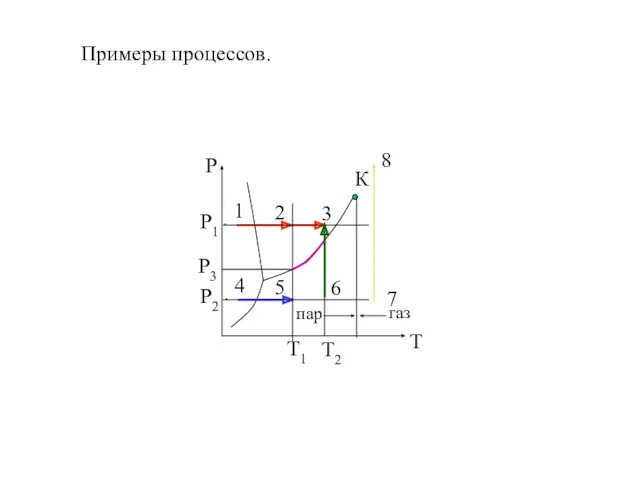
- 21. Примеры процессов.
- 22. Двухкомпонентная система [К=2(вода+ растворенное вeщество А)], молекулярный раствор. α→ 0 p0 –давление насыщенного пара (Н2Опар )
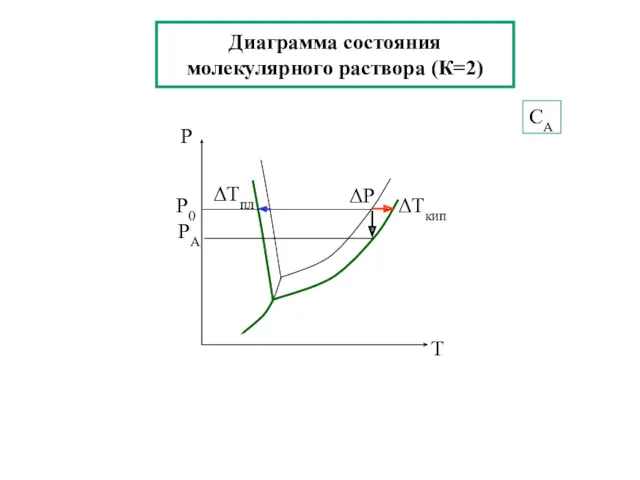
- 23. Диаграмма состояния молекулярного раствора (К=2) СА
- 24. Кипение и кристаллизация растворов Повышение температуры кипения раствора по сравнению с чистым растворителем (ΔТкип) прямо пропорционально
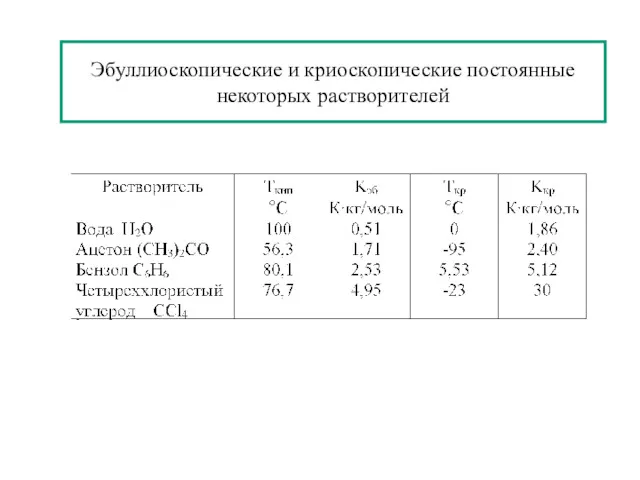
- 25. Эбуллиоскопические и криоскопические постоянные некоторых растворителей
- 27. Скачать презентацию









![Водородный показатель pH = –lg[H+] Нейтральная среда pH = 7](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/146214/slide-11.jpg)


![Произведение растворимости - ПР S-растворимость осадка[моль/л] [Kat+] = x·S [моль/л]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/146214/slide-16.jpg)

![Двухкомпонентная система [К=2(вода+ растворенное вeщество А)], молекулярный раствор. α→ 0](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/146214/slide-21.jpg)

 Типы химических реакций
Типы химических реакций Закон сохранения массы веществ
Закон сохранения массы веществ Современная химия. (Лекция 6)
Современная химия. (Лекция 6) Зиянды организмдерге қарсы органикалық және органикалық емес қосылыстарды қолдануға негізделген тәсіл
Зиянды организмдерге қарсы органикалық және органикалық емес қосылыстарды қолдануға негізделген тәсіл Кристаллические решетки
Кристаллические решетки Аналитические химические реакции. Классификация аналитических химических реакций
Аналитические химические реакции. Классификация аналитических химических реакций Материаловедение и технологии конструкционных материалов
Материаловедение и технологии конструкционных материалов Хімічний склад жувальної гумки
Хімічний склад жувальної гумки Мыльное чудо своими руками. История мыловарения. Изготовление мыла в домашних условиях
Мыльное чудо своими руками. История мыловарения. Изготовление мыла в домашних условиях Элементы триады железа: Fe, Co, Ni. (Лекция 16)
Элементы триады железа: Fe, Co, Ni. (Лекция 16) Техника безопасности в химической лаборатории и на уроках химии
Техника безопасности в химической лаборатории и на уроках химии Моющие средства
Моющие средства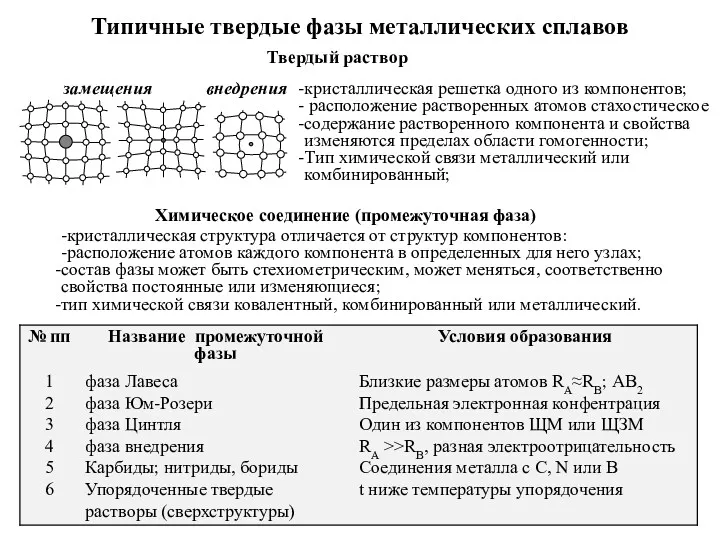 Типичные твердые фазы металлических сплавов
Типичные твердые фазы металлических сплавов Гигиена питания школьников
Гигиена питания школьников Классификация химических реакций
Классификация химических реакций Геохимия литосферы
Геохимия литосферы Гомополисахариды (углеводы растений)
Гомополисахариды (углеводы растений) Простые вещества. Металлы и неметаллы
Простые вещества. Металлы и неметаллы Полифенолды қосылыстар. Флавоноидтар
Полифенолды қосылыстар. Флавоноидтар Физико-химические свойства белков. Количественные (колориметрические) методы определения концентрации белка
Физико-химические свойства белков. Количественные (колориметрические) методы определения концентрации белка Гидролиз солей
Гидролиз солей Необоротні і оборотні хімічні процеси. Хімічна рівновага. Принцип Ле Шательє
Необоротні і оборотні хімічні процеси. Хімічна рівновага. Принцип Ле Шательє Введение. Развитие химической технологии как науки
Введение. Развитие химической технологии как науки Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Щелочные металлы IА группы. Литий
Щелочные металлы IА группы. Литий Окисно-відновні реакції. 9 клас
Окисно-відновні реакції. 9 клас Пластмассы, синтетические каучуки
Пластмассы, синтетические каучуки Роль химии в создании новых материалов
Роль химии в создании новых материалов