Содержание
- 2. Литий — элемент главной подгруппы первой группы, второго периода периодической системы химических элементов Д. И. Менделеева,
- 3. Распространение Лития в природе Литий довольно широко распространен в земной коре,Другой тип месторождений лития — рассолы
- 4. Физические свойства Лития Компактный Литий- серебристо-белый металл, быстро покрывающийся темно-серым налетом, состоящим из нитрида LiaN и
- 5. Химические свойства Лития Литий является щелочным металлом, который не хранится в керосине (к тому же плотность
- 6. Как получают Литий? В настоящее время для получения металлического лития его природные минералы или разлагают серной
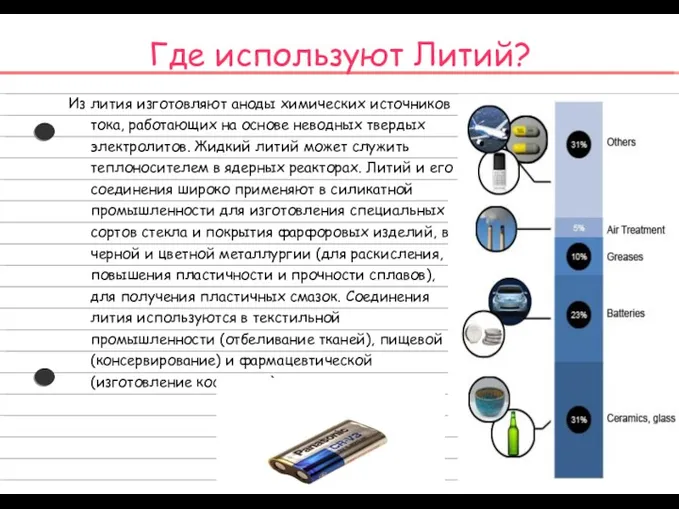
- 7. Где используют Литий? Из лития изготовляют аноды химических источников тока, работающих на основе неводных твердых электролитов.
- 9. Скачать презентацию





 Неорганическая химия
Неорганическая химия Соли Mg SO4 – сульфат магния
Соли Mg SO4 – сульфат магния Дисахаридтер. Сахароза
Дисахаридтер. Сахароза Химическая промышленность
Химическая промышленность Типы химических реакций. Практическая работа
Типы химических реакций. Практическая работа Химический элемент фосфор
Химический элемент фосфор Предмет органической химии
Предмет органической химии Кислоты. Электронное пособие для 8-го класса (по учебнику Рудзитис)
Кислоты. Электронное пособие для 8-го класса (по учебнику Рудзитис) Курсовая работа. Оптимизация рецептуры вареных колбасных изделий по пищевым добавкам
Курсовая работа. Оптимизация рецептуры вареных колбасных изделий по пищевым добавкам Предмет органической химии. Основные положения теории химического строения органических соединений
Предмет органической химии. Основные положения теории химического строения органических соединений Общая характеристика неметаллов
Общая характеристика неметаллов Металлы и сплавы в искусстве
Металлы и сплавы в искусстве Химиялық элементтер
Химиялық элементтер Вода – основа жизни на Земле
Вода – основа жизни на Земле Алкани
Алкани Физические явления в химии. Чистые вещества и смеси
Физические явления в химии. Чистые вещества и смеси Интеллектуальная игра Знатоки по химии
Интеллектуальная игра Знатоки по химии Химия. Викторина
Химия. Викторина Щелочные металлы
Щелочные металлы Диеновые углеводороды или алкадиены (тема 4)
Диеновые углеводороды или алкадиены (тема 4) Фенол. 10 класс
Фенол. 10 класс Бензин. Физико-химические свойства бензина
Бензин. Физико-химические свойства бензина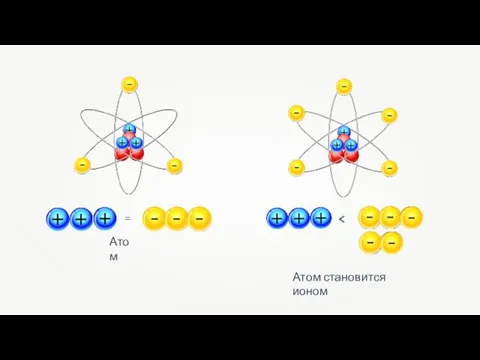 Ионная связь
Ионная связь Игра по химии В рамках периодической таблицы
Игра по химии В рамках периодической таблицы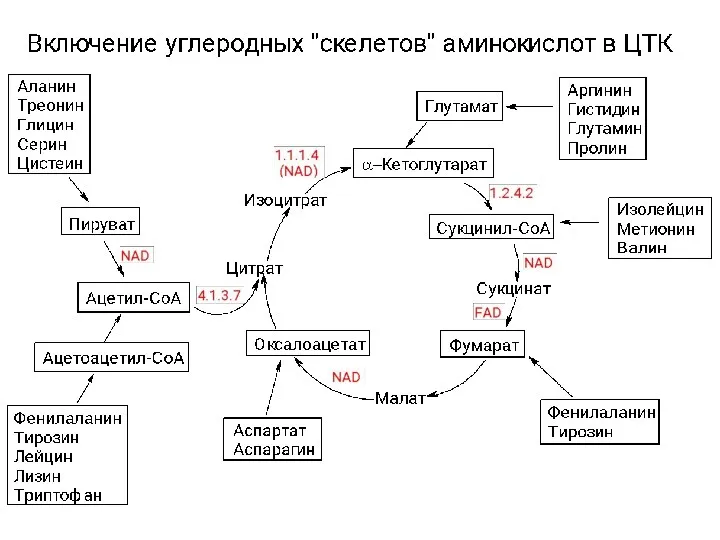 Катаболизм аминокислот
Катаболизм аминокислот Уравнение состояния идеального газа
Уравнение состояния идеального газа Необоротні і оборотні хімічні процеси. Хімічна рівновага
Необоротні і оборотні хімічні процеси. Хімічна рівновага Химия и биологическая роль элементов VIIА-группы
Химия и биологическая роль элементов VIIА-группы