Слайд 2

Цели и задачи работы:
Уметь составлять уравнения химических реакций, расставлять коэффициенты
Уметь определять
тип химической реакции
Научится приемам грамотного обращения с химическим оборудованием, веществами
Научится выполнять химический эксперимент согласно правилам техники безопасности
Слайд 3

Оборудование и вещества
Лабораторное оборудование:
- штатив для пробирок, пробирки
Вещества:
простые вещества: металлы - Zn
сложные вещества: оксиды - CaO; Н2О
раствор кислоты - HCl
раствор щелочи - NaOH
растворы солей - CuCl2
Na2CO3
BaCl2
Na2SO4
индикатор: фенолфталеин, лакмус
Слайд 4
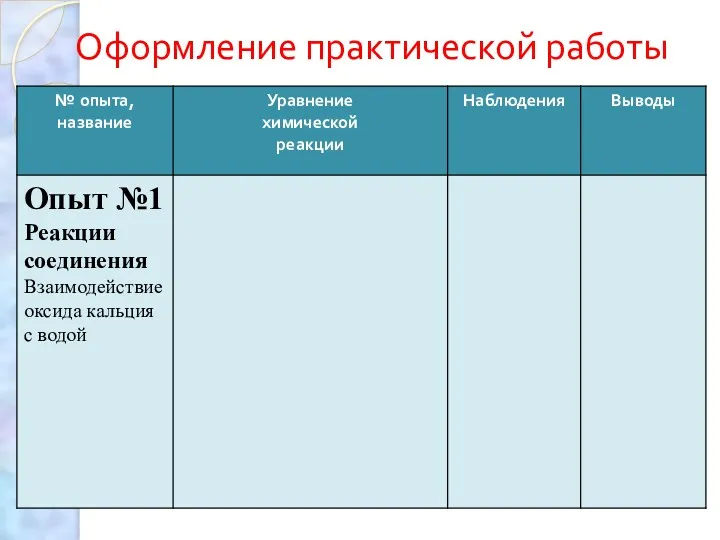
Оформление практической работы
Слайд 5

Реакции соединения
Опыт №1 «Взаимодействие оксида кальция с водой»
Возьмите чистую пробирку.
Аккуратно поместите в нее порошок CaO столбиком в 0,5 - 1 см.
В пробирку с порошком оксида кальция прилейте воду, так, чтобы высота раствора в пробирке не превышала 3-4 см
Аккуратно взболтайте получившийся раствор
Составьте уравнение протекающей химической реакции, расставьте коэффициенты
CaO + Н2О ?
5. В пробирку с приготовленным раствором добавьте 1-2 кап. Индикатора – фенолфталеина. Какие изменения вы наблюдаете? Дайте обоснованный ответ Заполните таблицу в тетради.
Слайд 6
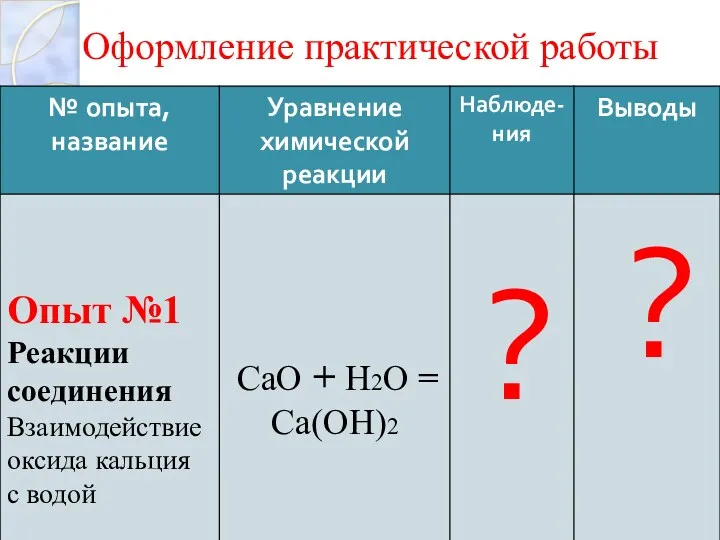
Оформление практической работы
Слайд 7

Реакции замещения
Опыт №2 «Взаимодействие цинка с раствором хлороводородной кислоты »
Возьмите
чистую пробирку. Аккуратно поместите в нее
1 гранулу Zn.
В пробирку с цинком прилейте раствор соляной (хлороводородной) кислоты столбиком в 1 см.
Составьте уравнение протекающей химической реакции, расставьте коэффициенты
Zn + НCl ?
4. Какие изменения вы наблюдаете? Дайте обоснованный ответ.
Слайд 8
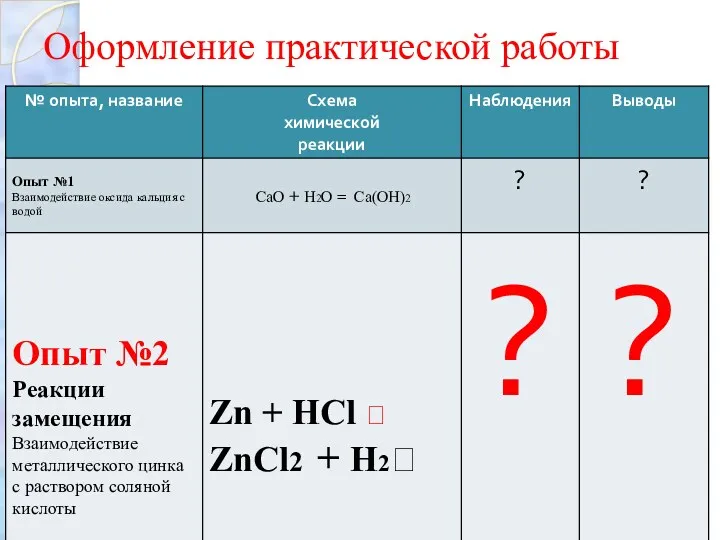
Оформление практической работы
Слайд 9

Реакции замещения
Опыт №3 «Взаимодействие цинка с раствором хлорида меди (II)
»
Возьмите чистую пробирку. Аккуратно поместите в нее
1 гранулу Zn.
В пробирку с цинком прилейте раствор хлорида меди (II) столбиком в 1- 2 см.
Составьте уравнение протекающей химической реакции, расставьте коэффициенты
Zn + CuCl2 ?
4. Какие изменения вы наблюдаете? Дайте обоснованный ответ. Заполните таблицу в тетради.
Слайд 10
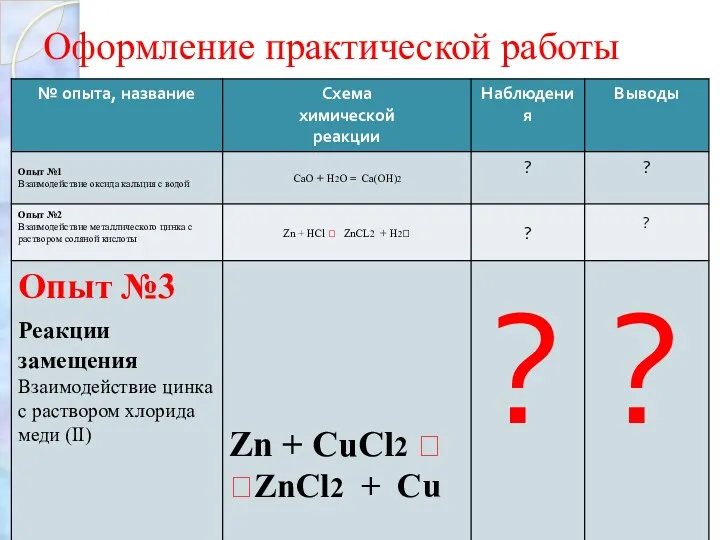
Оформление практической работы
Слайд 11

Реакции обмена
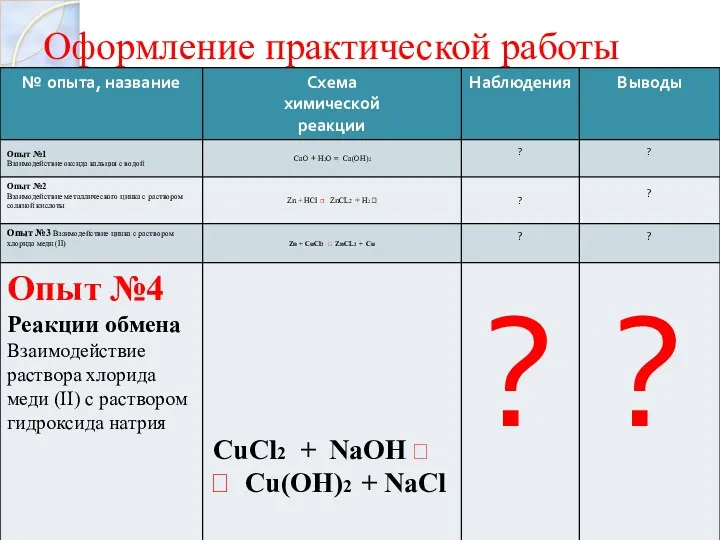
Опыт №4 «Взаимодействие раствора хлорида меди (II) с раствором
гидроксида натрия »
Возьмите чистую пробирку. Аккуратно налейте в нее
раствора хлорида меди (II) столбиком в 1 см.
В пробирку с раствором хлорида меди (II) прилейте несколько капель раствора гидроксида натрия до образования осадка.
Составьте уравнение протекающей химической реакции, расставьте коэффициенты
CuCl2 + NaOH ?
4. Какие изменения вы наблюдаете? Дайте обоснованный ответ. Заполните таблицу в тетради.
Слайд 12
Оформление практической работы
Слайд 13

Реакции обмена
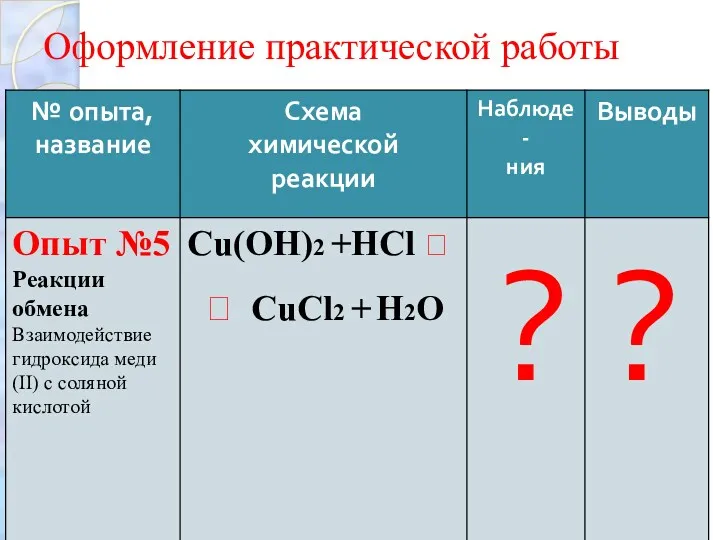
Опыт №5 «Взаимодействие гидроксида меди (II) с раствором cоляной
кислоты »
Возьмите пробирку в которой вы проводили опыт №4. В пробирке должен находиться осадок ярко голубого цвета
Аккуратно добавьте в эту пробирку несколько капель раствора соляной кислоты до растворения осадка.
Составьте уравнение протекающей химической реакции, расставьте коэффициенты
Cu(OH)2 + HCl ?
4. Какие изменения вы наблюдаете? Дайте обоснованный ответ. Заполните таблицу в тетради.
Слайд 14
Оформление практической работы
Слайд 15

Реакции обмена
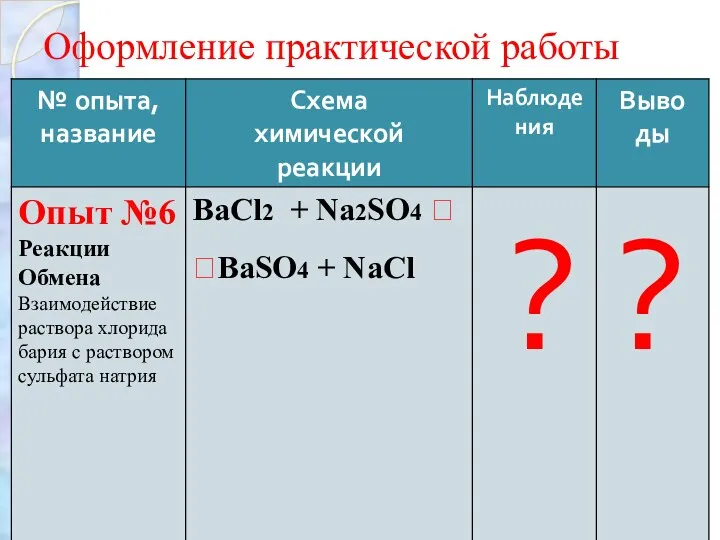
Опыт №6 «Взаимодействие раствора хлорида бария с раствором сульфата
натрия»
Возьмите чистую пробирку. Аккуратно налейте в нее
раствора хлорида бария столбиком в 1 см.
Аккуратно добавьте в эту пробирку несколько капель раствора сульфата натрия до образования осадка.
Составьте уравнение протекающей химической реакции, расставьте коэффициенты
BaCl2 + Na2SO4 ?
4. Какие изменения вы наблюдаете? Дайте обоснованный ответ. Заполните таблицу в тетради.
Слайд 16
Оформление практической работы
Слайд 17

Реакции обмена
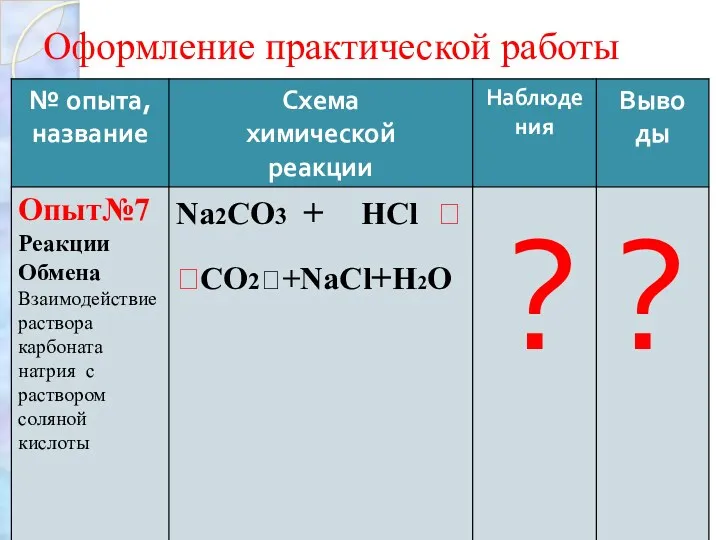
Опыт №7 «Взаимодействие раствора карбоната натрия с раствором соляной кислоты»
Возьмите
чистую пробирку. Аккуратно налейте в нее
раствор карбоната натрия столбиком в 1 см.
Аккуратно добавьте в эту пробирку несколько капель раствора соляной кислоты до образования пузырьков газа.
Составьте уравнение протекающей химической реакции, расставьте коэффициенты
Na2СO3 + HCl ?
4. Какие изменения вы наблюдаете? Дайте обоснованный ответ. Заполните таблицу в тетради.
Слайд 18
Оформление практической работы

















 Вуглеводи. Класифікація вуглеводів
Вуглеводи. Класифікація вуглеводів Обмен нуклеотидов
Обмен нуклеотидов Introduction to Periodic Table
Introduction to Periodic Table Геохимия метасоматтческого процесса. (Лекция 7)
Геохимия метасоматтческого процесса. (Лекция 7) Применение жиров
Применение жиров Периодический закон и периодическая система Д.И. Менделеева. 9 класс
Периодический закон и периодическая система Д.И. Менделеева. 9 класс Иондық байланыс
Иондық байланыс IV группа главная подгруппа
IV группа главная подгруппа Теория растворов. Диффузия в растворах. Коллигативные свойства растворов
Теория растворов. Диффузия в растворах. Коллигативные свойства растворов Лекция 7. Электрофильное замещение в ароматических системах
Лекция 7. Электрофильное замещение в ароматических системах Менделеевские уроки. День науки
Менделеевские уроки. День науки Молекулы и атомы. Броуновское движение
Молекулы и атомы. Броуновское движение Основні класи неорганічних сполук
Основні класи неорганічних сполук Предмет химии. Вещества
Предмет химии. Вещества Гетероатомные соединения нефти
Гетероатомные соединения нефти Акарицидтер. Тетразиндер. Бензи-латтар. Сульфоқышқыл туындылары. Хина-золиндер . Пирозолдар. Пиридазипондар
Акарицидтер. Тетразиндер. Бензи-латтар. Сульфоқышқыл туындылары. Хина-золиндер . Пирозолдар. Пиридазипондар Алканы. Пропан - С3Н8
Алканы. Пропан - С3Н8 Кислотные и основные свойства органических соединений
Кислотные и основные свойства органических соединений Соли Mg SO4 – сульфат магния
Соли Mg SO4 – сульфат магния Химические фундаментные болты
Химические фундаментные болты Каучук и резина
Каучук и резина Жаңа дәрілерді жасау
Жаңа дәрілерді жасау Расчет распределения пор по размерам из изотерм адсорбции
Расчет распределения пор по размерам из изотерм адсорбции Качественные реакции. Анионы
Качественные реакции. Анионы Structural revision of (+)-uprolide F diacetate confirmed by asymmetric total synthesis
Structural revision of (+)-uprolide F diacetate confirmed by asymmetric total synthesis Алкены.10 класс
Алкены.10 класс Характеристики атома. Электроотрицательность. Шкала Полинга. Изменения химических свойств элементов в ПСЭ. (Лекция 1.2)
Характеристики атома. Электроотрицательность. Шкала Полинга. Изменения химических свойств элементов в ПСЭ. (Лекция 1.2) Хром. Физические и химические свойства
Хром. Физические и химические свойства