Содержание
- 2. Электрофильное присоединение по Марковникову Получается только вещество А. Фактором, определяющим направление присоединения, является устойчивость промежуточного карбокатиона,
- 3. Пероксидный эффект Хараша В присутствии пероксидов присоединение бромистого водорода к алкенам идет против правила Марковникова. Из
- 4. Электрофильное замещение в ароматических системах Лекция 7
- 5. Качественные реакции на ненасыщенность для алкенов и алкинов Обесцвечивание бромной воды Обесцвечивание раствора перманганата калия (реакция
- 6. Строение молекулы бензола Схема образования π-связей в молекуле бензола Делокализация электронной плотности в молекуле бензола Масштабная
- 7. Арены и алкены: действие электрофилов Для ароматических соединений характерные реакции электрофильного замещения (SE)
- 8. Электрофилы Электрофильные реагенты (Е, Е+) – это частицы, образующие новые ковалентные связи за счет пары электронов
- 9. Сила электрофилов 1.1. Сильные электрофилы NO2+(Ион нитрония, нитроил-катион); комплексы Cl2 или Br2 с различными кислотами Льюиса
- 10. Механизм реакций SE в ароматическом кольце
- 11. Резонансные структуры σ-комплекса
- 12. Энергетическая диаграмма реакции SE в ароматическом кольце V = k[ArH][E+] Реакция второго порядка
- 13. Устойчивость аренониевых ионов Мезитилен образует аренониевый ион при взаимодействии с HF в присутствии BF3, устойчивый до
- 14. Стабильные аренониевые ионы
- 15. Как заместитель в бензольном кольце влияет на скорость SE в целом? Как заместитель в бензольном кольце
- 16. Изомерные σ-комплексы "ипсо" обозначает атаку или замещение в положение, несущее заместитель, отличный от водорода. Из орто-,
- 17. Влияние заместителей на скорость SE Электронодонорные заместители (D) повышают электронную плотность кольца и увеличивают скорость реакции
- 18. Правила ориентации в монозамещенных аренах Ориентирующее влияние заместителей обуславливают: 1) Электронные эффекты заместителей (статический фактор): распределение
- 19. Активируют сильно (+ + +), умеренно (+ +), слабо (+); дезактивируют сильно ( _ _ _
- 20. Статический фактор: влияние электронакцепторов на ориентацию SE Электрофильная атака идет в мета-положение, которое менее дезактивировано (бОльший
- 21. Статический фактор: влияние электронодоноров на ориентацию SE Электрофильная атака идет в орто- и пара-положения, которые более
- 22. Электрофильное замещение в монозамещенных бензолах: статический фактор Активирующие, орто-, пара-ориентанты : Дезактивирующие, мета-ориентанты Более высокая электронная
- 23. Динамический фактор: влияние алкилов на ориентацию SE При взаимодействии толуола с электрофилом атака в орто- и
- 24. Динамический фактор: влияние галогенов на ориентацию SE - I > + M Вносят наибольший вклад в
- 25. При замещении в мета-положении карбокатионы дестабилизированы за счет электростатического взаимодействия карбокатионного центра с положительным концом диполя
- 26. Во всех граничных формулах происходит электростатическое отталкивание между карбокатионным центром и положительным концом диполя связи С-N.
- 27. Примеры влияния ориентантов I и II-го рода в монозамещенных аренах
- 28. Примеры влияния ориентантов I и II-го рода в монозамещенных аренах
- 29. Правила ориентации в дизамещенных аренах: согласованное влияние заместителей Заместители направляют электрофильный агент в одно и то
- 30. Пример: согласованное влияние заместителей Выходы реакции нитрования
- 31. Ориентирующее влияние одного заместителя не совпадает по направлению с влиянием другого заместителя Правила ориентации в дизамещенных
- 32. Если в бензольном кольце имеются сильная и слабая активирующие группы, то ориентация в основном определяется сильной
- 33. Правила ориентации в дизамещенных аренах: несогласованное влияние заместителей Если в бензольном кольце имеются активирующая и дезактивирующая
- 34. Реакции электрофильного замещения (SE) аренов
- 35. Галогенирование моноядерных аренов π-комплекс σ-комплекс δ+ δ+ δ- δ- Генерирование электрофильного агента толуол орто-хлоротолуол пара-хлоротолуол +
- 36. Нитрование моноядерных аренов: синтез 2,4,6-тринитротолуола толуол орто-нитротолуол пара-нитротолуол олеум 2,4,6-тринитротолуол тротил
- 37. Сульфирование толуола
- 38. Реакция Фриделя-Крафтса Введение в бензольное кольцо алкильных или ацильных групп Алкилирующие реагенты: галогеноалканы, алкены, спирты Ацилирующие
- 39. Алкилирование по Фриделю-Крафтсу
- 40. Ограничения реакции алкилирования Фриделя-Крафтса Обратимая реакция (обратная реакция – дезалкилирование) Соединения с электроноакцепторными заместителями ( дезактивируют
- 41. Ацилирование по Фриделю-Крафтсу - +
- 42. Реакции SE конденсированных аренов и небензоидных ароматических систем 1. Электрофильное замещение в соединениях данного типа также
- 43. Реакции SE нафталинов Электрофильное замещение в нафталине приводит к одинаковой потере энергии стабилизации (на стадии образования
- 44. Реакции SE конденсированных аренов и небензоидных ароматических систем
- 45. Реакции SE антрацена и фенантрена Центральные ядра в антрацене и фенантрене более реакционноспособны, чем периферийные. Электрофильное
- 47. Скачать презентацию
 Топливо и топливосжигающие устройства
Топливо и топливосжигающие устройства Брейн – ринг. Мини – ЕГЭ по химии
Брейн – ринг. Мини – ЕГЭ по химии Спирти. 3агальна характеристика спиртів
Спирти. 3агальна характеристика спиртів Основные классы неорганических соединений
Основные классы неорганических соединений Предмет органической химии. Теория химического строения органических веществ
Предмет органической химии. Теория химического строения органических веществ Необоротні і оборотні хімічні процеси. Хімічна рівновага. Принцип Ле Шательє
Необоротні і оборотні хімічні процеси. Хімічна рівновага. Принцип Ле Шательє Строение атома азота
Строение атома азота Решение задач в химии (ОГЭ, ЕГЭ, Олимпиады)
Решение задач в химии (ОГЭ, ЕГЭ, Олимпиады) Массовая доля вещества в растворе. 8 класс
Массовая доля вещества в растворе. 8 класс Состав, строение и свойства аминокислот
Состав, строение и свойства аминокислот Алюминий. Природные соединения алюминия
Алюминий. Природные соединения алюминия Водород. Общая характеристика, получение, свойства
Водород. Общая характеристика, получение, свойства Эквиваленты веществ. Жидкое состояние, растворы
Эквиваленты веществ. Жидкое состояние, растворы Техника безопасности на уроках химии
Техника безопасности на уроках химии Наглядное пособие Динамические модели. Кристаллы. Немолекулярные вещества. Простые вещества
Наглядное пособие Динамические модели. Кристаллы. Немолекулярные вещества. Простые вещества Углеводы (сахариды)
Углеводы (сахариды) Оценка опасности взрыва горючих газов
Оценка опасности взрыва горючих газов Кислородсодержащие органические соединения. 9 класс
Кислородсодержащие органические соединения. 9 класс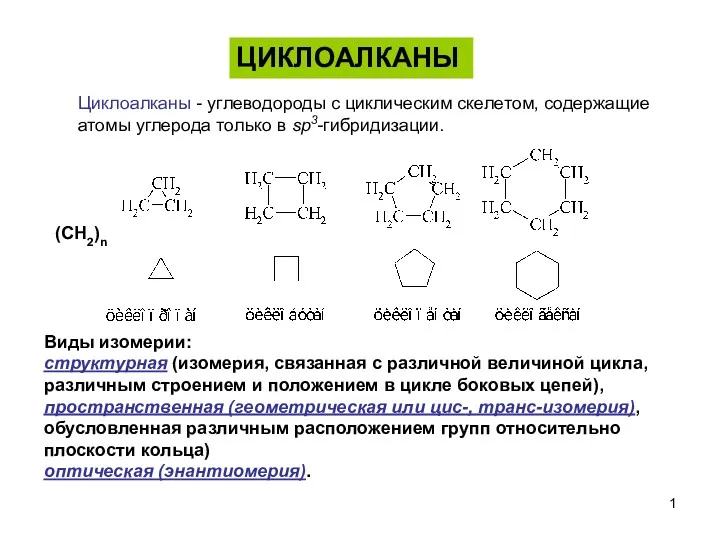 Циклоалканы
Циклоалканы Катализ органических реакций. (Лекция 15)
Катализ органических реакций. (Лекция 15) Способы выражения состава раствора. Задача 7
Способы выражения состава раствора. Задача 7 Классы неорганических соединений
Классы неорганических соединений Характеристика азота и фосфора. Свойства азота
Характеристика азота и фосфора. Свойства азота Химические свойства металлов. Коррозия металлов
Химические свойства металлов. Коррозия металлов Оксиды, их классификация и свойства
Оксиды, их классификация и свойства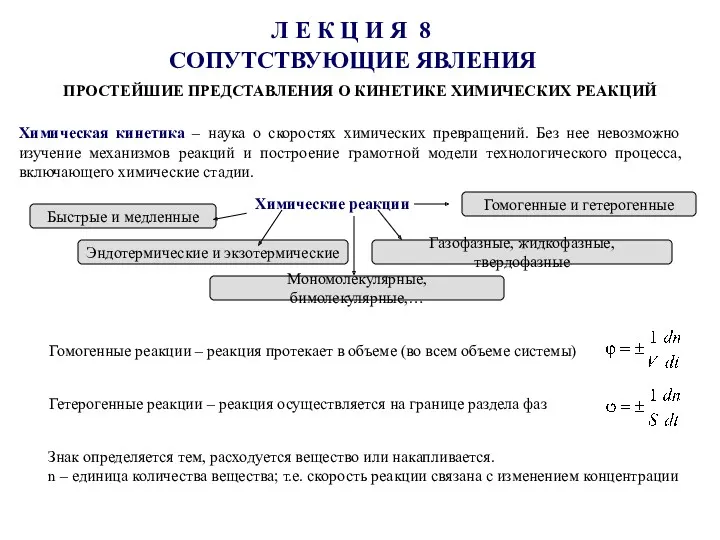 Простейшие представления о кинетике химических реакций
Простейшие представления о кинетике химических реакций Влияние катализатора на скорость химической реакции. Катализ
Влияние катализатора на скорость химической реакции. Катализ Оксиды(1)
Оксиды(1)