Содержание
- 2. Оксиды-это сложные вещества, которые состоят из двух элементов, одним из которых является кислород. Общая формула оксидов:
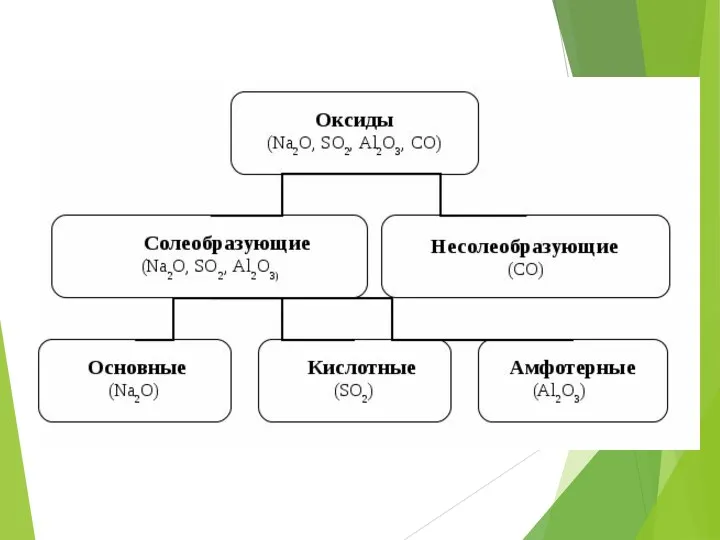
- 5. Несолебразующими называют такие оксиды, которые не взаимодействуют ни с кислотами, ни с щелочами и не образуют
- 6. Солеобразующими называются оксиды, которые взаимодействуют с кислотами или с щелочами с образованием соли и воды.
- 7. Солеобразующие оксиды:
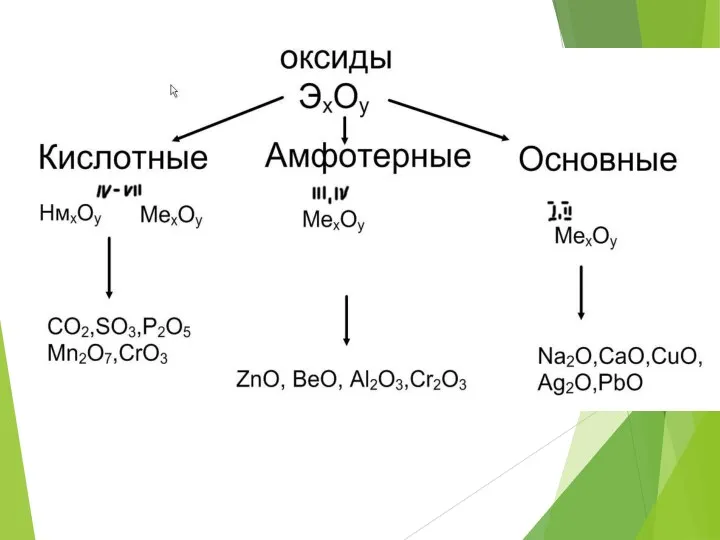
- 8. Кислотные оксиды-это такие оксиды, которым соответствуют кислоты (оксиды неМе или металлов с валентностью 3-7) CO2 -
- 9. Нерастворимый в воде кислотный оксид SiO2
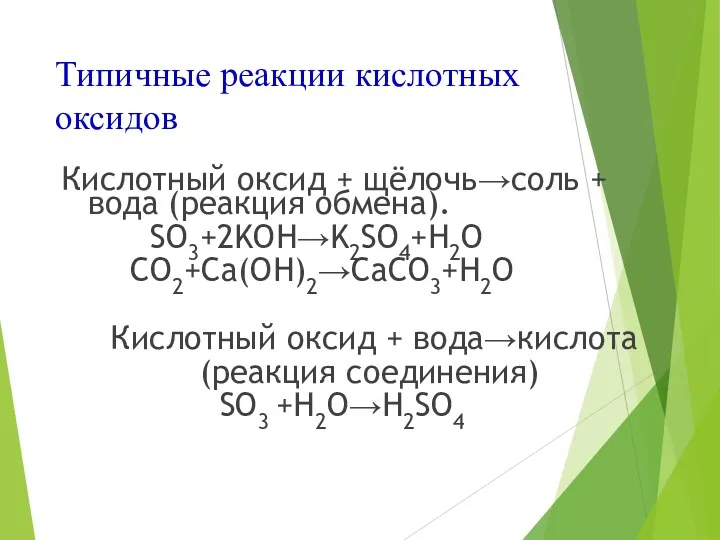
- 10. Типичные реакции кислотных оксидов Кислотный оксид + щёлочь→соль + вода (реакция обмена). SO3+2KOH→K2SO4+H2O CO2+Ca(OH)2→CaCO3+H2O Кислотный оксид
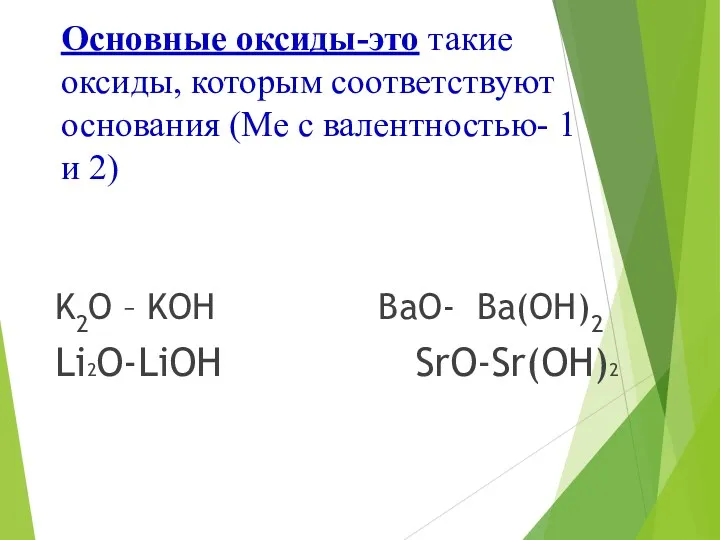
- 11. Основные оксиды-это такие оксиды, которым соответствуют основания (Ме с валентностью- 1 и 2) K2O – KOH
- 12. Типичные реакции основных оксидов Основный оксид + кислота→соль + вода (реакция обмена) CuO + H2SO4→CuSO4 +
- 13. Общие свойства оксидов: Основный оксид + кислотный оксид→ соль (реакция соединения) Li2O + CO2 → Li2CO3
- 14. Методы получения оксидов: 1. Взаимодействие простых веществ с кислородом S + O2 = SO2 2.Взаимодействие сложных
- 15. Задания для закрепления изученной темы: 1).Какие из перечисленных веществ являются оксидами? КОН; SiO2; H2SO4; CaO; NaCl;
- 16. Задание 3:Осуществить следующие превращение: алюминий→оксид алюминия →гидроксид алюминия→бромид алюминия→алюминий. Напишите уравнения реакций.
- 18. Скачать презентацию











 Железо и его соединения
Железо и его соединения Техника безопасности в кабинете химии
Техника безопасности в кабинете химии Технология гидролизных производств
Технология гидролизных производств Группа щелочных габброидов
Группа щелочных габброидов Галогены в Периодической системе Д.И. Менделеева
Галогены в Периодической системе Д.И. Менделеева Решение задач. Способы выражения состава раствора
Решение задач. Способы выражения состава раствора Щелочноземельные металлы Положение в периодической таблице
Щелочноземельные металлы Положение в периодической таблице Хімічне виробництво сталі
Хімічне виробництво сталі Химия элементов IVA группы
Химия элементов IVA группы Аналитическая химия. Качественный анализ
Аналитическая химия. Качественный анализ Механизмы органических реакций. (Лекция 2)
Механизмы органических реакций. (Лекция 2) Реологические свойства полимеров
Реологические свойства полимеров Строение атома
Строение атома Соли в свете теории электролитической диссоциации
Соли в свете теории электролитической диссоциации Бром. Общие сведения
Бром. Общие сведения Предельные одноатомные спирты
Предельные одноатомные спирты Натуральные, искуственные и синтетические материалы
Натуральные, искуственные и синтетические материалы Вода - основа жизни
Вода - основа жизни Роль химии в создании новых материалов
Роль химии в создании новых материалов Ауыз судың химиялық тұрғыдан зиянсыздығын сипаттаушы көрсеткіштер
Ауыз судың химиялық тұрғыдан зиянсыздығын сипаттаушы көрсеткіштер Кислоты. 8 класс
Кислоты. 8 класс Электролитическая диссоциация. Протолитическая теория кислот и оснований. Лекция №5
Электролитическая диссоциация. Протолитическая теория кислот и оснований. Лекция №5 Медь. Физические свойства
Медь. Физические свойства Металдардың физикалық қасиеттерін ажырата білу
Металдардың физикалық қасиеттерін ажырата білу Альдегіди. Будова молекул
Альдегіди. Будова молекул В мире химии. Периодический закон и ПСХЭ
В мире химии. Периодический закон и ПСХЭ Определение разных форм угольной кислоты
Определение разных форм угольной кислоты Кинетика химических реакций. Химическое равновесие
Кинетика химических реакций. Химическое равновесие