Содержание
- 2. Цель урока: Сформировать понятие о солях как классе электролитов; Рассмотреть общие химические свойства солей в свете
- 3. Соли – твердые вещества; Тип химической связи – ионный; Соли – растворимые в воде, нерастворимые малорастворимые
- 4. Соли – это сложные вещества, состоящие из атомов металла и кислотного остатка. Соли – это сложные
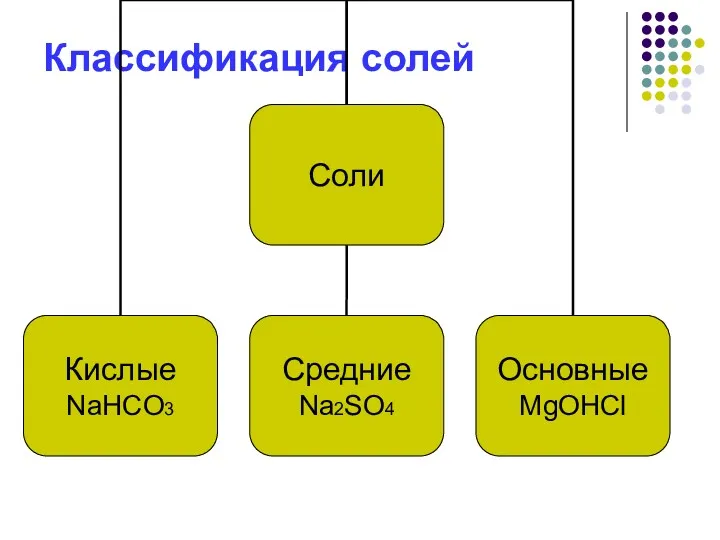
- 5. Классификация солей
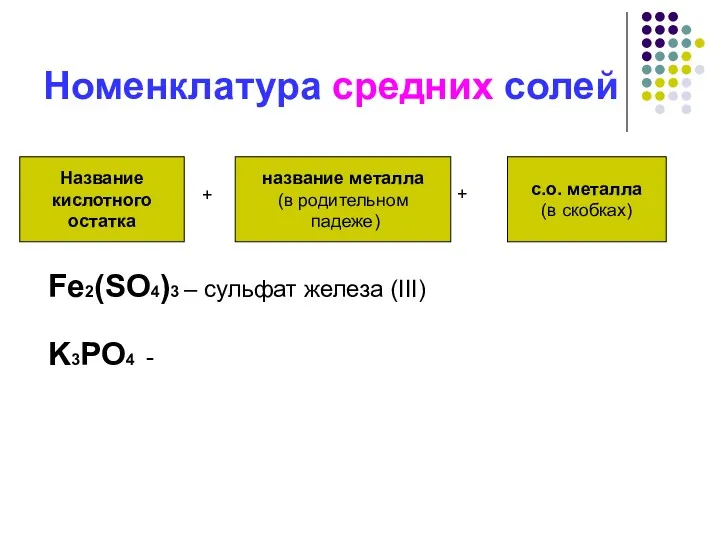
- 6. Номенклатура средних солей Название кислотного остатка название металла (в родительном падеже) с.о. металла (в скобках) +
- 7. Средними называют соли, которые образуются при полном замещении атомов водорода в кислоте атомами металлов: H3PO4 +
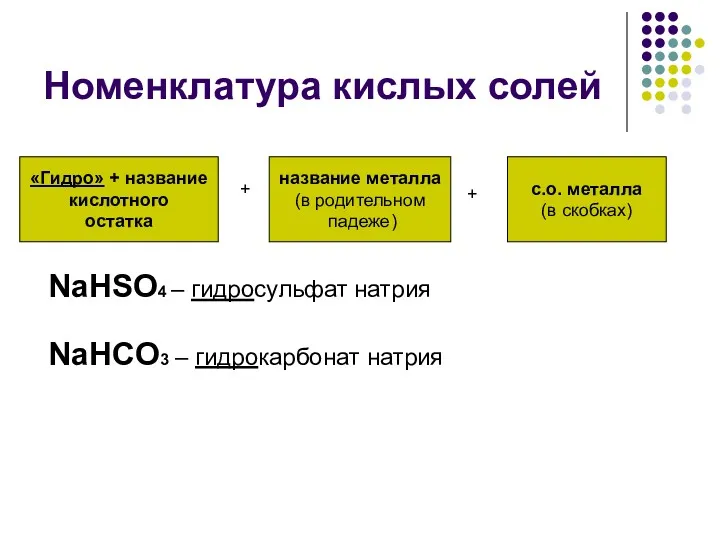
- 8. Номенклатура кислых солей «Гидро» + название кислотного остатка название металла (в родительном падеже) с.о. металла (в
- 9. Кислыми называют соли, которые образуются при неполном замещении атомов водорода в кислоте на атомы металлов: H3PO4
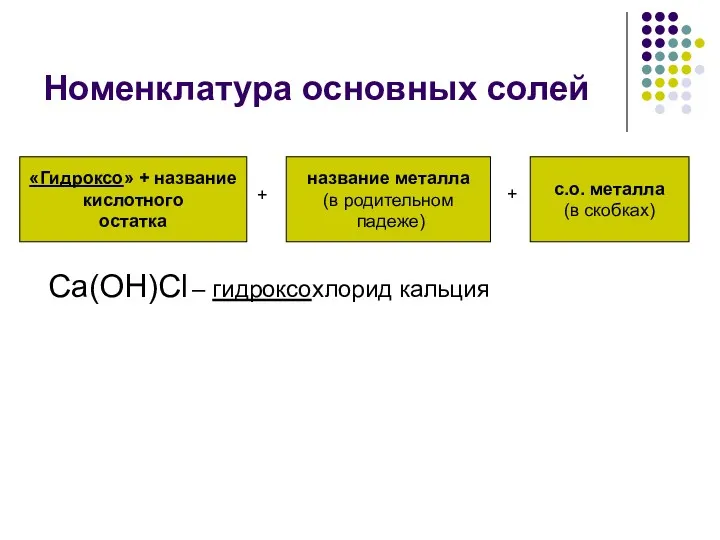
- 10. Номенклатура основных солей «Гидроксо» + название кислотного остатка название металла (в родительном падеже) с.о. металла (в
- 11. Основными называют соли, в которых кроме кислотного остатка присутствуют гидроксогруппы: Mg(OH)2 + HCl = MgOHCl +
- 12. Химические свойства солей Соль + кислота → другая соль + другая кислота BaCl2 + H2SO4 →
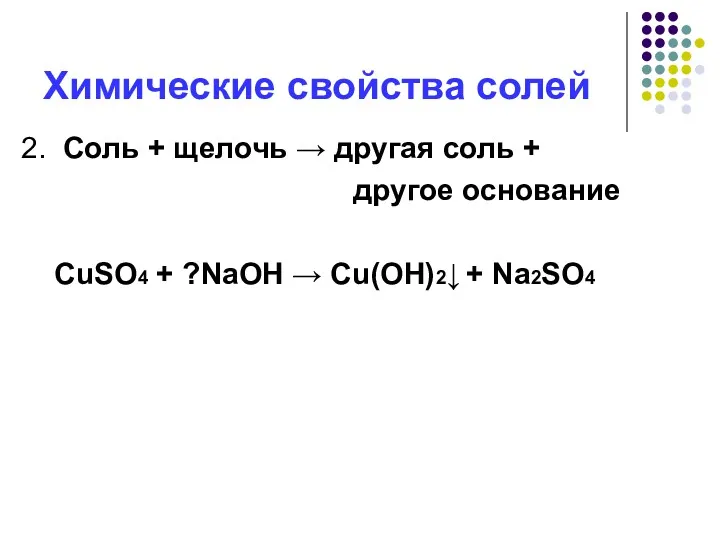
- 13. Химические свойства солей 2. Соль + щелочь → другая соль + другое основание CuSO4 + ?NaOH
- 14. Химические свойства солей 3. Соль1 + соль 2 → соль 3 + соль 4 ?NaCl +
- 15. Химические свойства солей Соль + металл → другая соль + другой металл Fe + CuSO4 →
- 16. Применение солей Карбонат кальция CaCO3 Гидрокарбонат натрия (питьевая сода) NaHCO3 Хлорид кальция CaCl2 Сульфат бария BaSO4
- 18. Скачать презентацию










 Альдегіди. Будова молекул
Альдегіди. Будова молекул Техника безопасности в кабинете химии
Техника безопасности в кабинете химии Химические свойства основных неорганических соединений в свете ЭД и ОВР
Химические свойства основных неорганических соединений в свете ЭД и ОВР Азотсодержащие гетероциклические соединения
Азотсодержащие гетероциклические соединения Алюминий и его соединения
Алюминий и его соединения Решение заданий по теме Химические свойства основных классов неорганических веществ
Решение заданий по теме Химические свойства основных классов неорганических веществ Смеси, растворы. Тест
Смеси, растворы. Тест Энтальпия. Тепловой эффект химической реакции. 11 класс
Энтальпия. Тепловой эффект химической реакции. 11 класс Неорганические строительные материалы. Стекло
Неорганические строительные материалы. Стекло Кислородсодержащие органические вещества. Фенолы
Кислородсодержащие органические вещества. Фенолы Азотная кислота и ее соли
Азотная кислота и ее соли Коррозия металлов
Коррозия металлов Периодический закон и периодическая система Д.И. Менделеева. Вторичная периодичность. Тема №1
Периодический закон и периодическая система Д.И. Менделеева. Вторичная периодичность. Тема №1 Органічні розчинники
Органічні розчинники Смолы и бальзамы. Воски и структурообразующие вещества в косметическом производстве
Смолы и бальзамы. Воски и структурообразующие вещества в косметическом производстве Окислительно-восстановительные реакции. Урок в 11 классе
Окислительно-восстановительные реакции. Урок в 11 классе Алкины (ацетиленовые углеводороды)
Алкины (ацетиленовые углеводороды) Антибиотики пенициллинового ряда
Антибиотики пенициллинового ряда Жидкокристаллические композиты ЖКК. Керамические композиционные материалы (ККМ). Углерод-углеродные композиционные (УУКМ)
Жидкокристаллические композиты ЖКК. Керамические композиционные материалы (ККМ). Углерод-углеродные композиционные (УУКМ) История открытия химических веществ
История открытия химических веществ Защитно-декоративные покрытия
Защитно-декоративные покрытия Титриметрический метод анализа
Титриметрический метод анализа Основные классы неорганических соединений
Основные классы неорганических соединений Спроби класифікації хімічних елементів
Спроби класифікації хімічних елементів Целевой и содержательный компоненты процесса обучения химии
Целевой и содержательный компоненты процесса обучения химии Понятие биогенности химических элементов
Понятие биогенности химических элементов Биохимическая трансформация веществ (2)
Биохимическая трансформация веществ (2) Происхождение названий минералов
Происхождение названий минералов