Кислоты – сложные вещества, которые состоят из катиона водорода H+ и аниона кислотного
остатка.
Химические свойства кислот
С основаниями и щелочами.
Cu(OH)2 + H2SO4 = CuSO4 + 2H2O
С солями.
Кислоты реагируют с растворимыми солями по механизму ионного обмена при условии образования газа, осадка или воды:
BaCl2+ H2SO4 = BaSO4↓ + 2HCl
Сильные кислоты могут вытеснять слабые из их нерастворимых солей:
CaCO3 + 2HCl = CaCl2 + H2O + CO2
С основными оксидами.
Na2O + 2HCl = 2NaCl + H2O
С металлами.
Кислоты-неокислители взаимодействуют только с металлами до водорода в ряду активностей металлов.
Кислоты-окислители — концентрированная серная кислота и азотная кислота любой концентрации — могут реагировать и с металлами после водорода.









 Физико-химия дисперсных систем
Физико-химия дисперсных систем Поверхностно-активные вещества
Поверхностно-активные вещества Ионный обмен. Хроматография
Ионный обмен. Хроматография Подготовительные курсы для абитуриентов химического факультета БГУ
Подготовительные курсы для абитуриентов химического факультета БГУ Дизельное топливо
Дизельное топливо Теплові прояви механічної, електричної та хімічної енергії
Теплові прояви механічної, електричної та хімічної енергії Химия элементов. Комплексные соединения. Основные понятия координационной теории. Номенклатура. Поведение в растворе
Химия элементов. Комплексные соединения. Основные понятия координационной теории. Номенклатура. Поведение в растворе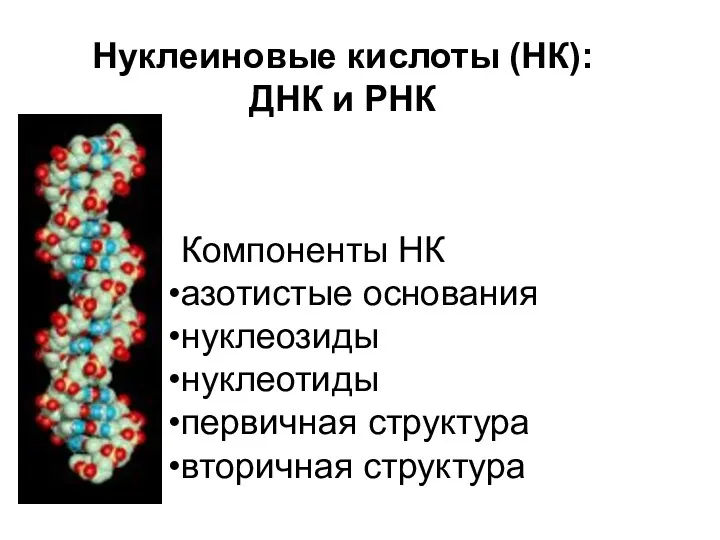 Нуклеиновые кислоты
Нуклеиновые кислоты Ізомери в природі
Ізомери в природі Поверхневі явища в дисперсних системах. Поверхнева енергія
Поверхневі явища в дисперсних системах. Поверхнева енергія Введение. Предмет и содержание фармацевтической химии, её связи с другими науками
Введение. Предмет и содержание фармацевтической химии, её связи с другими науками Кобальт. Химический элемент
Кобальт. Химический элемент Альдегиды и кетоны
Альдегиды и кетоны Кремний и его соединения
Кремний и его соединения Теории химической кинетики. Лекция 4
Теории химической кинетики. Лекция 4 Марганец и хром
Марганец и хром Физические и химические свойства оснований
Физические и химические свойства оснований Золото
Золото Нанокомпозттерді алу жолдары
Нанокомпозттерді алу жолдары Взаимное влияние атомов в молекулах. Шкалы электроотрицательности
Взаимное влияние атомов в молекулах. Шкалы электроотрицательности Формы нахождения минералов в природе
Формы нахождения минералов в природе Обмен индивидуальных аминокислот
Обмен индивидуальных аминокислот Механические свойства минералов
Механические свойства минералов Классификация и номенклатура неорганических соединений (Малый химический тренажёр)
Классификация и номенклатура неорганических соединений (Малый химический тренажёр)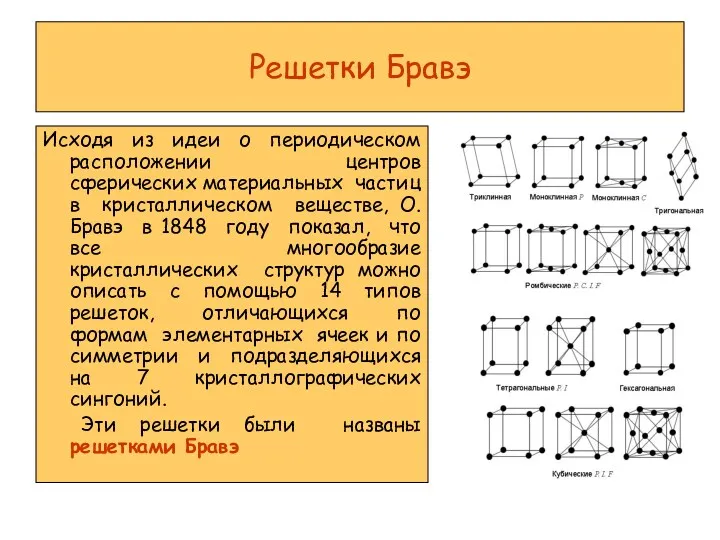 Решетки Бравэ
Решетки Бравэ Получение наночастиц в сверхкритическом флюиде
Получение наночастиц в сверхкритическом флюиде Окислительно – восстановительные реакции
Окислительно – восстановительные реакции 5.Алкины
5.Алкины