Содержание
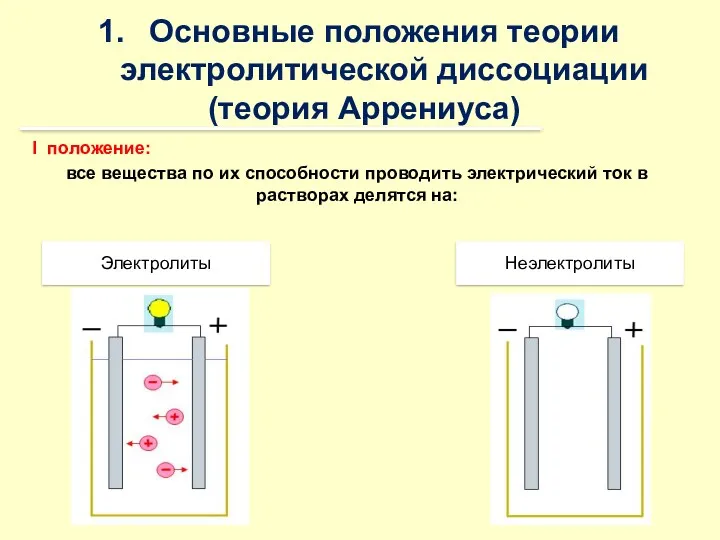
- 2. Вещества Электролиты - вещества, растворы и расплавы которых проводят электрический ток. Неэлектролиты - вещества, растворы и
- 3. Неэлектролиты вещества, которые содержат ковалентные неполярные или малополярные связи. Эти связи не распадаются на ионы. газы,
- 4. Электролиты Вещества, которые содержат ионные и ковалентные полярные связи. Эти связи легко распадаются на ионы. Неорганические
- 5. Электролитическая диссоциация – процесс распада электролита на ионы при растворении его в воде или расплавлении
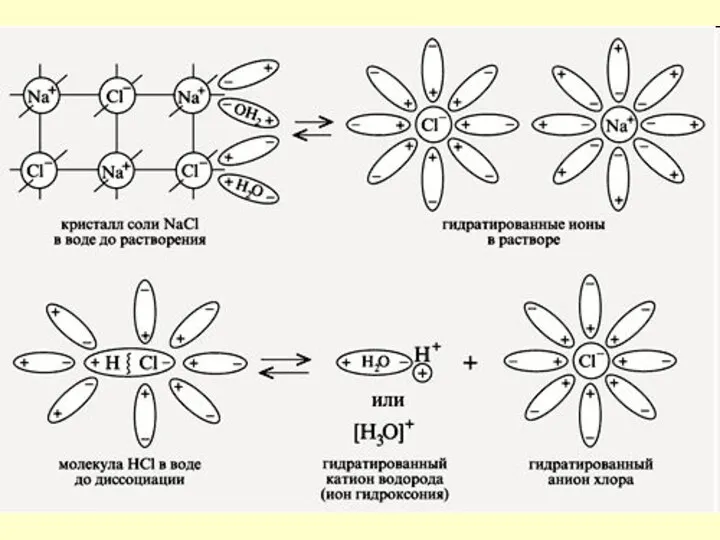
- 6. Вещества с ионной связью Кристаллическая решетка NaCl Кристалл NaCl
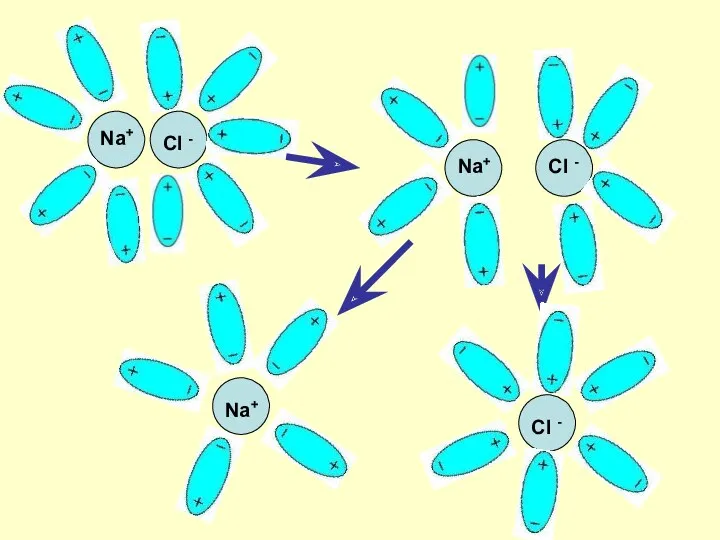
- 7. Механизм ЭД ионных веществ Ориентация диполей воды вокруг кристаллов соли. Образование между молекулами воды и ионами
- 8. Na+ Cl - Na+ Cl - Na+ Cl -
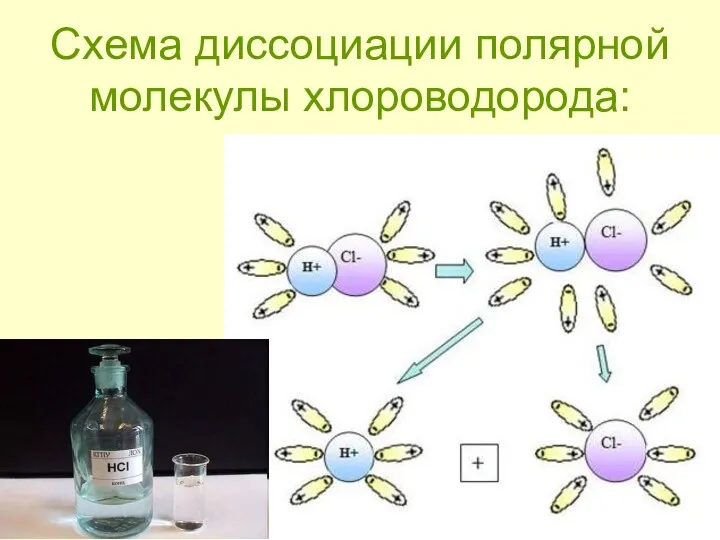
- 9. Механизм ЭД полярных веществ ориентация диполей воды вокруг полярной молекулы. еще большая поляризация полярной молекулы и
- 10. Схема диссоциации полярной молекулы хлороводорода:
- 11. Электролиты Сильные - при растворении в воде практически полностью распадаются на ионы. Слабые частично распадаются на
- 12. Сильные электролиты вещества с ионными или сильно полярными связями. все хорошо растворимые соли, сильные кислоты (HCl,
- 13. Слабые электролиты вещества с неполярными и малополярными связями: 1) почти все органические кислоты (CH3COOH, C2H5COOH и
- 14. Степень диссоциации Степень диссоциации (α) - отношение числа распавшихся на ионы молекул (n) к общему числу
- 15. Электролитическая диссоциация веществ, идущая с образованием свободных ионов объясняет электрическую проводимость растворов. CaCl2 = Ca2+ +
- 16. Диссоциация кислот осуществляется ступенчато. На каждой ступени отщепляется один ион водорода. H Cl = H+ +
- 17. Диссоциация оснований Ba(OH)2 = Ba2+ + 2OH- Сa(OH)2 = Сa2+ + 2OH- Основания - при диссоциации
- 18. Диссоциация солей Средние соли – соли, состоящие из атомов металла и кислотного остатка, диссоциируют в одну
- 19. Диссоциация солей Кислые соли – соли, в состав молекул которых кроме атомов металла входят атомы водорода,
- 20. Диссоциация солей Основные соли – соли, в состав молекул которых кроме атомов металла входит гидроксид ион,
- 21. Шведский ученый Сванте Аррениус(1859-1927) В 1887 году создал теорию ЭД. В 1903году был удостоен Нобелевской премии
- 22. Каблуков И.А. Кистяковский В.А.
- 23. Русские химики И.А.Каблуков и В.А.Кистяковский применили к объяснению электролитической диссоциации химическую теорию растворов Д.И.Менделеева и доказали,
- 24. Основные положения теории ЭД 1. Электролиты в водной среде (и в расплавленном состоянии) распадаются на положительно
- 26. Основные положения теории ЭД 2. Беспорядочное движение ионов в растворе под действием электрического поля становится направленным:
- 27. Основные положения теории ЭД 3. Диссоциация – обратимый процесс: параллельно с распадом молекул на ионы (диссоциацией)
- 28. 4. Степень электролитической диссоциации (a) зависит от природы электролита и растворителя, температуры и концентрации. Она показывает
- 29. Основные положения теории ЭД 5. Свойства ионов резко отличаются от свойств нейтральных атомов составляющих их элементов.
- 30. I. ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ. ЭЛЕКТРИЧЕСКАЯ ПРОВОДИМОСТЬ РАСТВОРОВ
- 31. Основные положения теории электролитической диссоциации (теория Аррениуса) I положение: все вещества по их способности проводить электрический
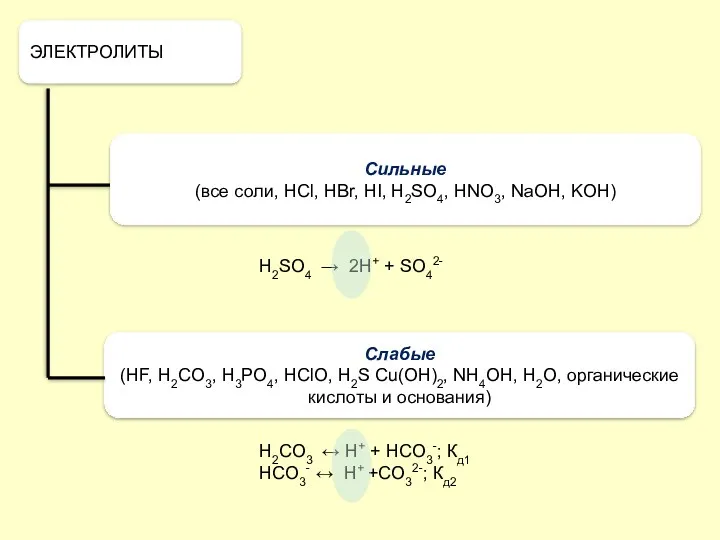
- 32. ЭЛЕКТРОЛИТЫ Слабые (HF, H2CO3, H3PO4, HClO, H2S Cu(OH)2, NH4OH, Н2О, органические кислоты и основания) Сильные (все
- 33. II положение: диссоциация количественно оценивается величиной степени диссоциации (α). Степень диссоциации – это отношение числа диссоциированных
- 34. III положение: к процессу диссоциации применим закон действующих масс, позволяющий записать выражение для константы диссоциации. «Закон
- 35. Константа диссоциации - это величина, характеризующая данный электролит. Кд не зависит от концентрации раствора. Формула для
- 36. 2. Электропроводность растворов электролитов ЭЛЕКТРОПРОВОДНОСТЬ - это способность растворов электролитов проводить электрический ток за счет движения
- 37. 2.1. Удельная электрическая проводимость (ℵ) это электрическая проводимость раствора, помещенного между 2 электродами площадью 1 см2
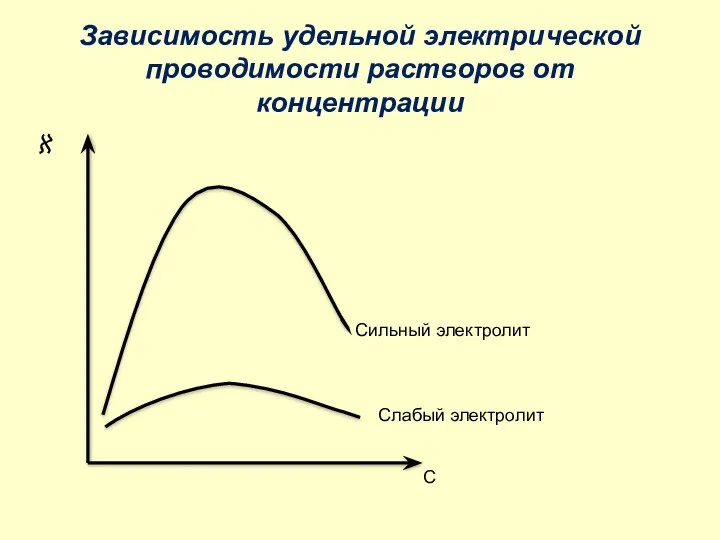
- 38. Зависимость удельной электрической проводимости растворов от концентрации Слабый электролит Сильный электролит
- 39. 2.2. Молярная (эквивалентная) электропроводность (λ) это электрическая проводимость раствора, содержащего 1 моль вещества при расстоянии между
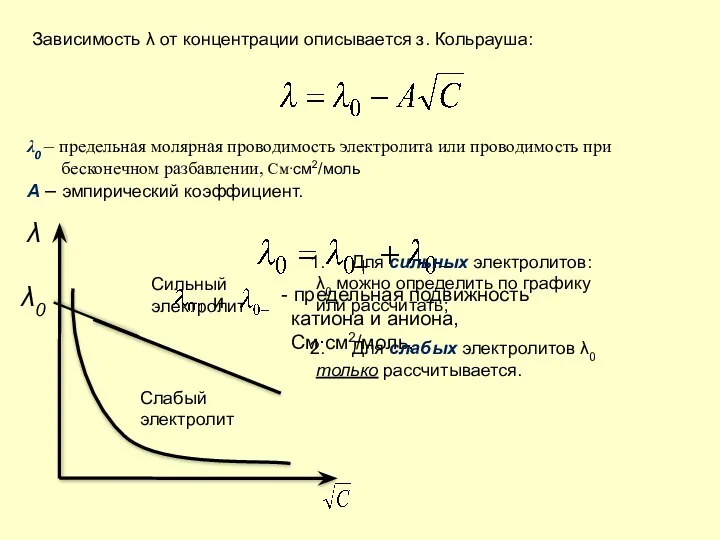
- 40. Зависимость λ от концентрации описывается з. Кольрауша: λ0 – предельная молярная проводимость электролита или проводимость при
- 42. Скачать презентацию
































 Типы химических реакций
Типы химических реакций Дисперсні системи. Загальні властивості розчинів
Дисперсні системи. Загальні властивості розчинів Фотохимический смог и химизм его образования
Фотохимический смог и химизм его образования алкадиены
алкадиены Алкалоиды и принципы их классификации
Алкалоиды и принципы их классификации Фуллерендер құрылымдары және олардың түрлерi
Фуллерендер құрылымдары және олардың түрлерi Электронно-ионный баланс и Закон Авогадро. 8 класс
Электронно-ионный баланс и Закон Авогадро. 8 класс Тіршілік процесіне қатысатын гетерофункционалды қосылыстар
Тіршілік процесіне қатысатын гетерофункционалды қосылыстар Коррозия металлов и способы защиты от коррозии
Коррозия металлов и способы защиты от коррозии 20231116_tipy_himicheskih_reaktsiy
20231116_tipy_himicheskih_reaktsiy Методика “Кольоропис”
Методика “Кольоропис” Кристаллические решетки
Кристаллические решетки Кондуктометрия
Кондуктометрия Розв'язування задач за рівнянням хімічних реакцій
Розв'язування задач за рівнянням хімічних реакцій Щелочные металлы
Щелочные металлы Дисперсные системы. Дисперсное состояние вещества. Лекция 10
Дисперсные системы. Дисперсное состояние вещества. Лекция 10 Пятичленные гетероциклы с одним гетероатомом
Пятичленные гетероциклы с одним гетероатомом Система питания двигателя от газобаллонной установки
Система питания двигателя от газобаллонной установки Реакции щелочных металлов (Группа 1) – Li, Na, K
Реакции щелочных металлов (Группа 1) – Li, Na, K Интеллектуальная игра Кто хочет стать отличником?. Химия. 11 класс
Интеллектуальная игра Кто хочет стать отличником?. Химия. 11 класс Алкадиены
Алкадиены Поверхностные явления
Поверхностные явления Хімія металургійних процесів. Теорія сплавів
Хімія металургійних процесів. Теорія сплавів Основы органической химии
Основы органической химии Физико-химия полимеров и их растворов
Физико-химия полимеров и их растворов Специфическое поведение гетерофункциональных соединений как результат взаимного влияния атомов
Специфическое поведение гетерофункциональных соединений как результат взаимного влияния атомов Природные источники углеводородов и их переработка
Природные источники углеводородов и их переработка Теория электролитической диссоциации
Теория электролитической диссоциации