Специфическое поведение гетерофункциональных соединений как результат взаимного влияния атомов презентация
Содержание
- 2. Теория химического строения Бутлеров Александр Михайлович 1861г Свойства веществ зависят не только от их состава, но
- 3. Электронный эффект Смещение электронной плотности по системе химических связей, вызванное присутствием заместителя, отличающегося электроотрицательностью (ЭО) от
- 4. Индуктивный эффект ( I ) Передача электронного влияния заместителя по цепи σ-связей. Передаётся по цепи σ-связей
- 5. Графически индуктивный эффект обозначается стрелкой по валентному штриху в сторону более ЭО атома: +I -I СН3
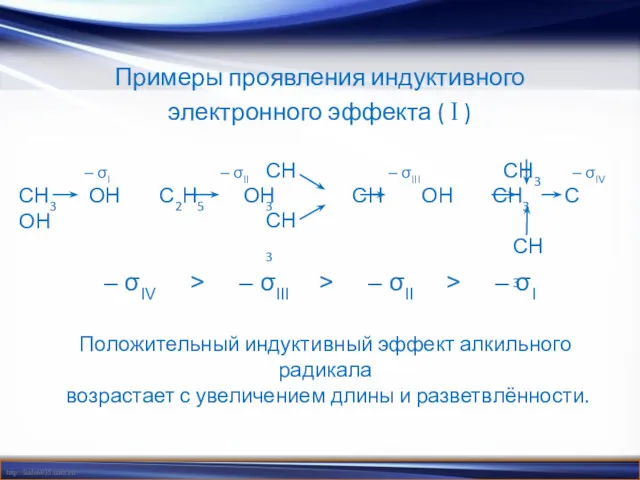
- 6. Примеры проявления индуктивного электронного эффекта ( I ) – σIV > – σIII > – σII
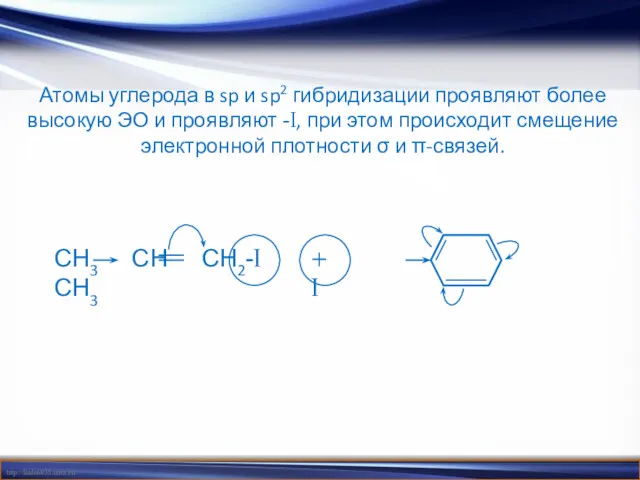
- 7. Атомы углерода в sp и sp2 гибридизации проявляют более высокую ЭО и проявляют -I, при этом
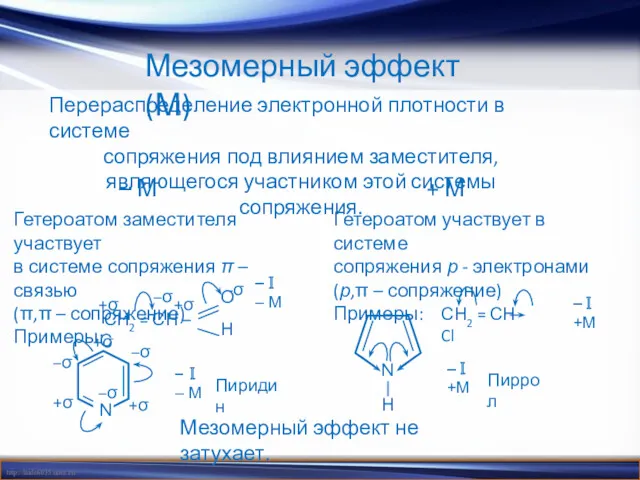
- 8. Мезомерный эффект (М) Перераспределение электронной плотности в системе сопряжения под влиянием заместителя, являющегося участником этой системы
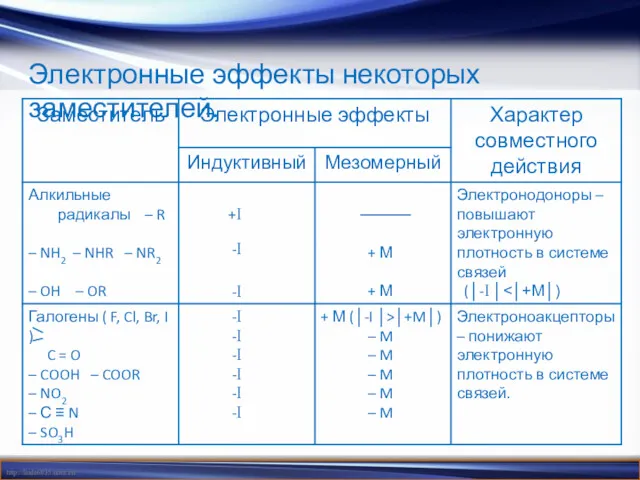
- 9. Электронные эффекты некоторых заместителей.
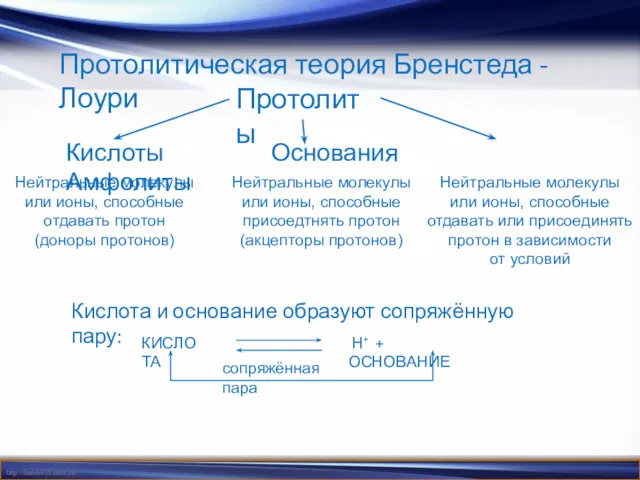
- 10. Протолитическая теория Бренстеда - Лоури Протолиты Кислоты Основания Амфолиты Нейтральные молекулы или ионы, способные отдавать протон
- 11. Кислотно – основное взаимодействие НА + В А – + ВН+ кислота основание сопряжённое основание сопряжённая
- 12. Качественная оценка силы кислоты определяется стабильностью сопряжённого основания (аниона). Факторы, обуславливающие стабильность аниона: I Природа атома
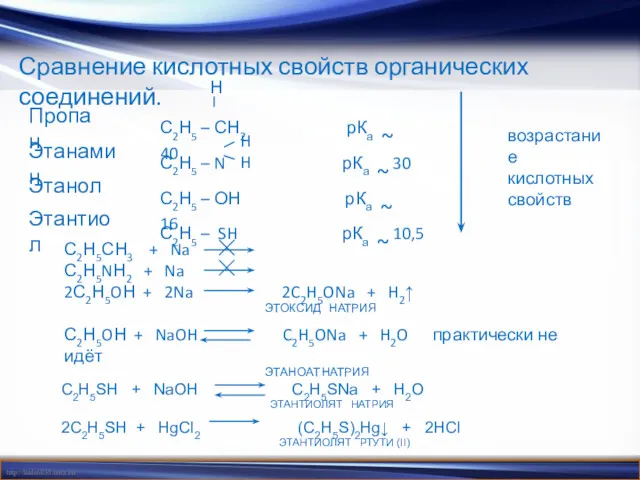
- 13. Сравнение кислотных свойств органических соединений. Пропан С2Н5 – СН2 рКа ~ 40 Н возрастание кислотных свойств
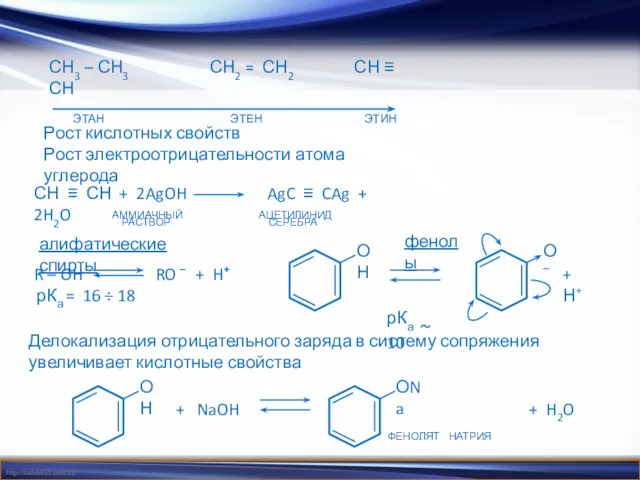
- 14. СН3 – СН3 СН2 = СН2 СН ≡ СН ЭТАН ЭТЕН ЭТИН Рост кислотных свойств Рост
- 15. Карбоновые кислоты проявляют наиболее высокие кислотные свойства Влияние радикала на карбоксильную группу приводит к изменению кислотных
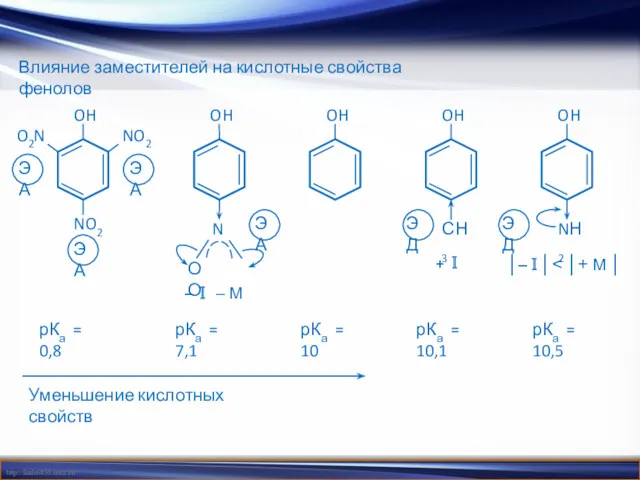
- 16. Влияние заместителей на кислотные свойства фенолов Уменьшение кислотных свойств O2N NO2 NO2 N О О –
- 17. Основание Бренстеда Присоединяют протон с образованием солей. Сила основания определяется доступностью для протона пары электронов гетероатома.
- 18. Ароматические амины слабее алифатических В амидах карбоновых кислот более сильным основным центром является оксогруппа R →
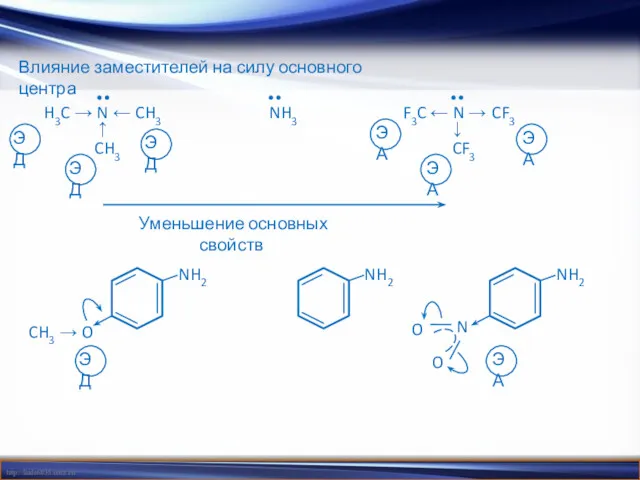
- 19. Влияние заместителей на силу основного центра Уменьшение основных свойств H3C → N ← CH3 ↑ CH3
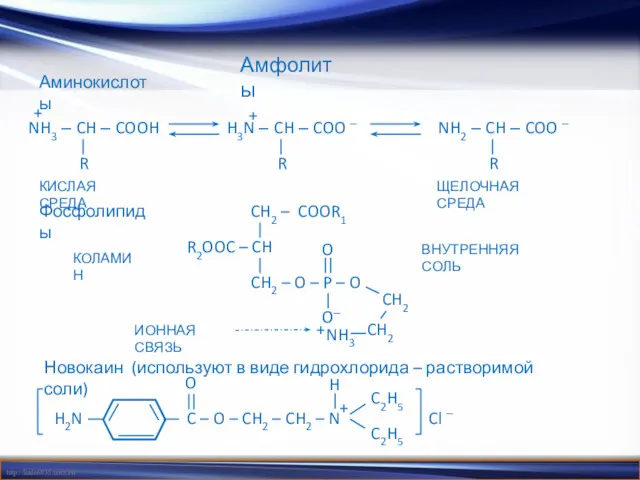
- 20. Амфолиты Аминокислоты Фосфолипиды Новокаин (используют в виде гидрохлорида – растворимой соли) + NH3 – CH –
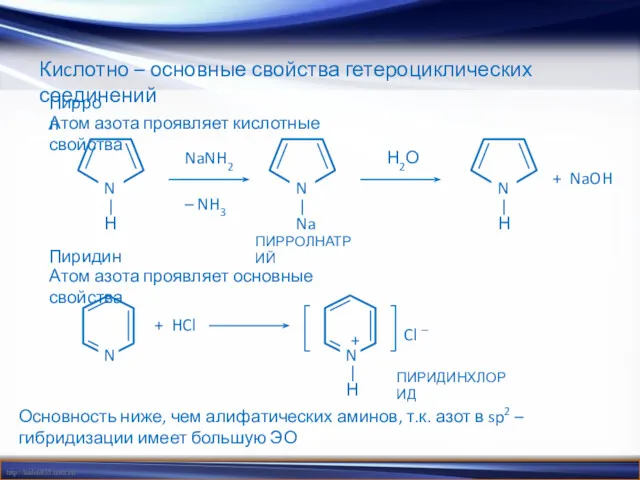
- 21. Киcлотно – основные свойства гетероциклических соединений Пиррол Атом азота проявляет кислотные свойства Пиридин Атом азота проявляет
- 23. Скачать презентацию









 Химический состав и физические свойства продовольственных товаров
Химический состав и физические свойства продовольственных товаров Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Типы расчетных задач, способы их решения. Задания 39-40
Типы расчетных задач, способы их решения. Задания 39-40 Механохимиялық активтеу әдісі
Механохимиялық активтеу әдісі Количественный учет влияния заместителя на реакционную способность и его использование для интерпретации механизмов реакций
Количественный учет влияния заместителя на реакционную способность и его использование для интерпретации механизмов реакций Аминокислоты и белки. 9 класс
Аминокислоты и белки. 9 класс Классификация химических реакций в органической химии
Классификация химических реакций в органической химии Кислоты. Серная кислота-H₂SO₄
Кислоты. Серная кислота-H₂SO₄ Польза и вред химического производства
Польза и вред химического производства Углеводы. 10 класс
Углеводы. 10 класс Ядовитые минералы
Ядовитые минералы Физико-химия дисперсных систем. Коллоидные растворы
Физико-химия дисперсных систем. Коллоидные растворы Скорость химических реакций. Факторы, влияющие на скорость химической реакции
Скорость химических реакций. Факторы, влияющие на скорость химической реакции Простые вещества металлы
Простые вещества металлы Химическая термодинамика. Экзаменационные вопросы
Химическая термодинамика. Экзаменационные вопросы Основи. Властивості, застосування гідроксидів Натрію і Калію
Основи. Властивості, застосування гідроксидів Натрію і Калію Обмен липидов
Обмен липидов Химические свойства, получение и применение крахмала
Химические свойства, получение и применение крахмала Кристаллическая решетка
Кристаллическая решетка Извлечение из растворов экстракцией органическими растворителями
Извлечение из растворов экстракцией органическими растворителями Хімічні сполуки у побуті
Хімічні сполуки у побуті Рентгеноструктуралық анализ. Лауе тәжірибесі, Брегг-Вульф теңдеуі, оны шығару жолдары
Рентгеноструктуралық анализ. Лауе тәжірибесі, Брегг-Вульф теңдеуі, оны шығару жолдары Кислые породы повышенной щелочности и щелочные
Кислые породы повышенной щелочности и щелочные Виды топлива
Виды топлива Побочная подгруппа 1 и 2. Медь
Побочная подгруппа 1 и 2. Медь Совместимость электродных материалов в новой электрохимической системе Li4Ti5O12/Li3V2(PO4)3 с традиционным электролитом для
Совместимость электродных материалов в новой электрохимической системе Li4Ti5O12/Li3V2(PO4)3 с традиционным электролитом для Подготовка к ГИА. А14. Определение характера среды раствора кислот и щелочей с помощью индикаторов. Реакции на ионы в растворе
Подготовка к ГИА. А14. Определение характера среды раствора кислот и щелочей с помощью индикаторов. Реакции на ионы в растворе Оксиди нітрогену
Оксиди нітрогену